Електрон має двоїсту природу: він може поводитися і як частинка, і як хвиля. Електрон у атомі не рухається за певними траєкторіями, а може перебувати в будь-якій частині навколо ядерного простору, проте ймовірність його перебування в різних частинах цього простору неоднакова. Простір навколо ядра, у якому найімовірніше перебування електрона, називається орбіталл ю.
Кожний електрон у атомі перебуває на певній відстані від ядра відповідно до запасу його енергії. Електрони з більш-менш однаковою енергією формують енергетичні рівн і, або електронні шар и.
Ф ізичний зміст номера періоду - ч исло заповнених електронами енергетичних рівнів у атомі даного елемента дорівнює номеру періоду, в якому він розташований .
Фізичний зміст номера групи - число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, в якій розміщений даний елемент.
У межах одного енергетичного рівня електрони можуть відрізнятися формою електронної хмар и, або орбітал і. Існують такі форми орбіталей: s -, p -, d -, f -орбіталі.
Електрони з однаковою формою електронної хмари утворюють однойменні енергетичні підрівн і: s -, p -, d -, f -підрівні.
Кількість підрівнів на кожному енергетичному рівні дорівнює номеру цього рівня.
Електрон на схемах позначається стрілкою, яка вказує його спін. Під спіном розуміють обертання електрона навколо своєї осі. Він позначається стрілкою: 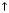 або
або 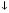 . Два електрони на одній орбіталі записуються
. Два електрони на одній орбіталі записуються 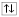 , але не
, але не 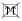 .
.
Будова електронних оболонок атомів елементів перших трьох періодів
|
|

Сейчас читают про:
 2015-10-13
2015-10-13 529
529







