Отримані умови рівноваги гетерогенної системи дозволяють визначити кількість фаз, що здатні одночасно знаходитися у рівновазі, або число незалежних параметрів гетерогенної системи (число термодинамічних ступенів свободи системи С), які можна змінювати без порушення її рівноваги. Цю задачу вирішив Дж. Гіббс і її результат називається правилом Гіббса.
Розгорнемо умову фазової рівноваги (15) для кожного компонента:
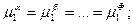
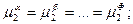 (16)
(16)
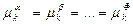 .
.
Як відомо, хімічні потенціали представляють собою функції температури, тиску і концентрації. Тому рівності (16) представляють собою рівняння, що зв’язують усі незалежні параметри, які визначають стан системи. У кожній строчці міститься Ф - 1 рівнянь, а число усіх строчок – K, отже, число рівнянь дорівнює (Ф – 1)K.
У рівняннях (14) не усі змінні у дійсності є незалежними. Як виходить з курсу математики, число незалежних змінних дорівнює різниці між числом усіх змінних і числом рівнянь. Отже, число незалежних змінних або число термодинамічних ступенів свободи системи:
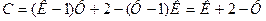 (17)
(17)
У тому випадку, якщо аналіз проводиться при постійному тиску:
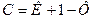 (18)
(18)
Якщо число термодинамічних ступенів свободи дорівнює нулю, це означає, що жодний з термодинамічних параметрів системи, які визначають стан системи, не може бути змінений без порушення рівноваги.
 2015-10-13
2015-10-13 341
341








