Поведение реальных газов и газовых смесей не подчиняется строго уравнению состояния идеальных газов, которое принято при составлении настоящих таблиц. Поэтому практически важно дать оценку точности предлагаемых таблиц в различных областях параметров состояния и указать область их применимости. Для такой оценки логично принять уравнение состояния реальных газов, которое по возможности хорошо отвечало бы поведению этих газов в интересующей области параметров состояния.
Анализ многочисленных экспериментальных данных по сжимаемости чистых газов показывает, что при умеренных давлениях (примерно до 5 МПа) и температурах, удаленных от критической, практически имеет место линейность изотерм в координатах р — pv в широком интервале температур (рис. 1).
Уравнение состояния газов для этой области может быть записано как
pv = RT + Bp, (17)
где В — функция температуры или так называемый второй вириальный коэффициент. Зная зависимость второго вириального коэффициента В от температуры для данного газа, можно определить зависимость калорических величин от давления для этого газа.
Легко показать, что влияние давления на энтальпию газа будет линейно, т. е.
h-h0 = B1р, (18)
где h — энтальпия реального газа; h0 — энтальпия газа в идеально-газовом состоянии (при р→0); В1 — функция температуры:
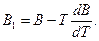 (19)
(19)
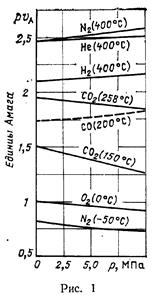
Определив таким способом влияние давления на энтальпию газа, можно оценить ту область давлений и температур, в которой это влияние будет сказываться в определенной степени. Задавшись допустимой погрешностью таблиц 0,5% (h — h0 = 0,005 h0), т. е. величиной того же порядка, что и погрешность таблиц водяного пара, по уравнению (18) для отдельных газов можно найти то предельное давление в зависимости от температуры, при котором погрешность таблиц не будет превосходить указанной величины.
На рис. 2 показаны значения отложенных по вертикальной оси предельных давлений для азота, кислорода, диоксида углерода и водяного пара в зависимости от температуры. Там же показан пример пользования графиком. (Обозначение следует читать: кривая 02 — для N2, кривая N2 — для 02).
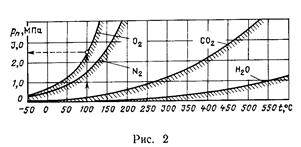
Для газовой смеси можно в первом приближении принять уравнение состояния в форме (17), а удельный объем смеси определить по правилу смешения по удельным объемам компонентов. В этом случае влияние давления на энтальпию газовой смеси будет также линейным:
причем Bi смеси определится по значениям 5i компонентов в соответствии с правилом аддитивности. Таким путем и для смеси может быть оценено то предельное давление, при котором погрешность таблиц не будет превосходить заданных 0,5 % •
Расчеты, произведенные на основе изложенных соображений, показывают, что предлагаемые таблицы обладают достаточной точ-
ностью в области давлений до 2,5—3 МПа для всех практически используемых в газотурбинной технике температур.
Следует отметить, что выполненное сопоставление теплоперепадов, найденных по существующим надежным, экспериментально обоснованным таблицам водяного пара и диоксида углерода, с соответствующими значениями, найденными по настоящим таблицам, показало их хорошее согласование (в пределах оцененной области применимости таблиц). При давлениях, вплоть до указанных на рис. 2 предельных, ни в одном случае действительный адиабатный теплоперепад не отличался от теплоперепада, найденного по таблицам, более чем на 0,5%, что служит хорошим подтверждением надежности принятого метода оценки области применимости таблиц. Оценка точности производилась для трехатомных газов по той причине, что они характеризуются наибольшим отклонением от уравнения состояния для идеальных газов в рассматриваемой области температур.
ПРИМЕРЫ ПОЛЬЗОВАНИЯ ТАБЛИЦАМИ
Пример 1. Сжатие воздуха в компрессоре.
Воздух, всасываемый в компрессор при давлении p1=0,l МПа и температуре 20 °С, сжимается до давления 0,4 МПа. Определить теоретическую работу адиабатного сжатия, действительную работу сжатия при внутреннем относительном КПД компрессора η0h= 0,85, температуру воздуха в конце сжатия и изменение энтропии.
Решение. Из табл. III.2 для t1 =20 °С находим π01 = 1,2788, h1 =293,3 кдж/кг и s10 = =6,6790 кДж/(кг∙К), где индекс 1 относится к данным всасываемого воздуха.
Для определения конечного состояния воздуха после адиабатного сжатия найдем относительное давление, соответствующее состоянию газа в конце сжатия:
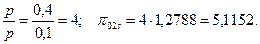
Из табл. Ш.2 интерполяцией определим значения h2s = 436,3 кДж/кг, s2s0 =
= 7,0769 кДж/(кг∙К) и t2s=161,71 °С, соответствующие π02 s. Теоретическая работа сжатия
Dhад = h2s—h1 =436,3 — 293,3= 143,0 кДж/кг. Действительная работа сжатия при η0h = 0,85
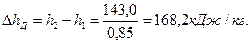
Найдем теперь параметры состояния воздуха в конце действительного процесса сжатия.
Энтальпия воздуха в конце сжатия
h2=h1+Dhд = 293,3 + 168,2 = 461,5 кДж/кг.
Из табл. Ш.2 находим
t2= 186,44 °С (h2 = 461,5 кДж/кг);
s2° = 7,1333 кДж/(кг∙К).
Изменение энтропии может быть определено по соотношению
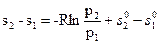
или
s2 - s1 = s20 - s2s0 ;
s2 — s1 =7,1333 — 7,0769 = 0,05664 кДж/(кг∙К).
Пример 2. Газообразный продукт сгорания топлива, имеющий следующий состав в объемных долях:
r (С02) =7,5%; r (O2) = 10%; r (N2) =76,5% и r (Н2O) =6,0%,
расширяется при совершении работы от p1 = 0,5 МПа до р2 = 0,1 МПа; соответствующие температуры равны t1 = 500°C и t2 = 290°С.
Определить работу расширения и внутренний относительный КПД процесса расширения.
Решение. Приближенное определение адиабатной работы расширения без учета энтропии смешения компонентов газовой смеси может быть выполнено по методу, описанному в [2]. Этот метод в случае газовой смеси с большим содержанием преобладающего компонента, как показали расчеты, дает небольшое расхождение с точным решением. Приближенное решение выполняется следующим образом.
По таблицам определим энтальпию смеси перед расширением, соответствующую начальной температуре t1 = 500°С:
Н1 (СO2) = 30809 кДж/кмоль; π01, (СО2) = 22,467;
H1 (Н20) =26 860 кДж/кмоль; π01 (Н2O) =41,249;
H1 (О2) = 23 591 кДж/кмоль; π01 (O2) = 181,20;
Н1 (N2) = 22 867 кДж/кмоль; π01 (N2) = 30,387;
H 1 cмеси = 30 809 • 0,075 + 26 860 • 0,060 + 23 591 • 0,10 + 22 867 • 0,765 =
= 23 774 кДж/кмоль.
Теперь определим по таблицам значения энтальпии в конце адиабатного расширения для каждого компонента в отдельности:
π02s (СO2) = 22,467/5 = 4,4934; H2s (С02) = 21 734 кДж/кмоль; t2s = 315,42 °С;
π02s (Н2O) = 41,249/5 = 8,2498; H2s (НгО) = 18 161 кДж/кмоль; t 2s = 264,84 °С
π02s (O2) = 181,20/5 = 36,240; H2s (02) = 15 095 кДж/кмэль; i2s = 238,2 °С;
π02s (N2) = 30,387/5 = 6,0774;
H2s (N2) = 14 485 кДж/кмоль; t2s = 223,9 °С.
Приближенно H2s смеси = 21 734∙0,075+18 161∙0,060+15 095∙0,100+14 485∙0,765 =
= 15 311 кДж/кмоль.
Теоретическая работа расширения
D H т =H1 cмеси – H2s cмеси = 23 774 — 15 311 = 8463 кДж/кмоль.
Определим действительную работу расширения, зная температуру газовой смеси в конце расширения. Для этого в табл. Ш.4, III.8, Ш.10 и III.12 найдем энтальпию компонентов при температуре t2 = 290°С (в конце действительного процесса расширения) и умножим ее на соответствующие мольные доли:
H2 (СO2) = 20 549 • 0,075 = 1541 кДж/кмoль;
H2 (Н2O) = 19 061 • 0,060 = 1144 кДж/кмоль
H2 (О2) = 16 725 • 0,0100 = 1672 кДж/кмоль;
H2 (N2) = 16 452 • 0,765 = 12 585 кДж/кмоль.
По правилу смешения
H2смеcи = 16942 кДж/кмоль. Действительная работа
D Hд = H1 смеси — H2 смеси = 23 774 — 16942 = 6832 кДж/кмоль. Внутренний относительный КПД процесса расширения
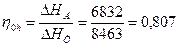
Для точного решения задачи следует определить значение 5°, соответствующее состоянию газовой смеси в конце изоэнтропного процесса.
Это значение определяется из уравнения (10):
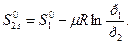
По таблицам для отдельных компонентов, используя правило смешения, найдем S10 смеси при температуре 500 °С:
S10(СО2) =255,59 кДж/(кмоль∙К);
S10(H20) =222,39 кДж/(кмоль∙К);
S10(02) =234,68 кДж/(кмоль∙К);
S10 (N2) =219,84 кДж/(кмоль∙К);
S10смеси = 255,59 • 0,075 + 222,39 • 0,060 + 234,68 -0,10+ 219,84 • 0,765 =
= 224,15 кДж/(кмоль∙К).
Тогда в конце изоэнтропного процесса
S20cмеси = 224,15 —8,3142∙ 1,6094 = 210,77 кДж/(кмоль∙К).
Теперь задача сводится к определению такой температуры газовой смеси, которой соответствует найденное значение S20cмеси. Для этого предварительно примем конечную температуру изоэнтропного процесса расширения смеси близкой к температуре для преобладающего компонента — в данном случае азота (см. приближенное решение). Для удобства интерполяции округлим ее до десятков в большую сторону, учитывая, что конечные температуры других газов при раздельном их расширении выше, чем для азота. Итак, примем t'2 =230 °С.
По таблицам для компонентов, используя правило смешения, найдем для этой температуры
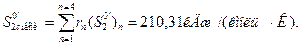
Таккак полученное значение S20 ' < S2 s0, второе предварительное значение температуры примем на 10 °С выше, т. е. t' 2 '=240 °С. Для этой температуры найдем
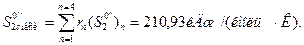
Теперь путем интерполяции найдем значение температуры газовой смеси в конце ее изоэнтропного расширения
t2s = 237,5 °С
и по этой температуре — мольную энтальпию смеси в конце расширения
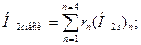
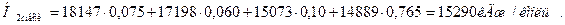
Теоретическая работа расширения (в точном расчете) равна DHт = H1 смеси— H2s смеси = 23 774—15290 = 8484 кДж/кмоль, т. е. на 21 кДж/кг, или всего на 0,25 %, больше, чем в приближенном расчете.
Внутренний относительный КПД процесса расширения
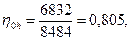
т. е. на 0,25 % меньше, чем при приближенном расчете.
 2015-10-13
2015-10-13 452
452








