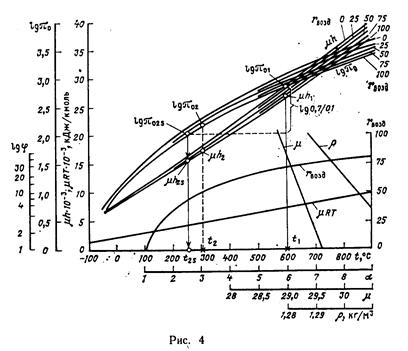
Пусть требуется построить диаграмму (рис. 4) для продуктов сгорания газа подземной газификации, имеющего следующий объемный состав: H2S = 0,6%; СО2=10,3%; О2 = 0,2%; СО =18,4%; Н2=11,1%; СН2=1,8% и N'2=57,6% (N'2 —атмосферный азот).
1. Теоретическое количество воздуха, необходимое для сгорания 1 м3 газа,
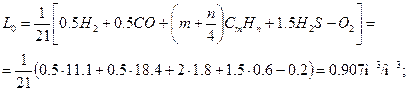
2. Объемный состав продуктов сгорания при α=1: объем трехатомных газов (без водяного пара)
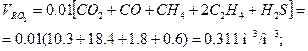
объем водяных паров: примем содержание влаги в топливе dt = =47,5 г/м3 и в воздухе d в = 8 г/м3, тогда
Vh2o = 0,01[Н8 + 2CH4 + 2С2Я4 + H2S + 0,124 (dT + αL0dв)] =
= 0,01 [11,1 + 2∙1,8 +0,6+ 0,124(47,5+ 0,907∙8,0)] = 0,221 м3/м3;
объем двухатомных газов
VR2 = 0,79L0 + 0,01N2 - 0,79. 0,907 + 0,01. 57,6 = 1,293 м3/м3; суммарный объем продуктов сгорания
V0 = ∑V = VRO2 + VH2O + VR2 = 0,311 + 0,221+ 1,293= 1,825 м3/м3.
Объемный состав продуктов сгорания при α=1:
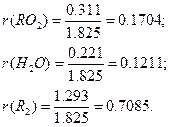
3. По найденному составу и значениям энтальпии и логарифма относительного давления отдельных компонентов, приведенным в табл. II.2—II.6, определим для разных температур с интервалом 50—100°С значения энтальпии и логарифма относительного давления для продукта сгорания при α=1 (примем, что RO2 представляет собой диоксид углерода, так как содержание SO2 в газе незначительно).
Воспользуемся для этого правилом смешения:
Hα=1 = H (СO2)∙ r (RO2) + H (H2O) ∙ r (Н2O) + H (N'2) ∙ r (R2), кДж/кмоль,
(lgπ0)α=i= lgπ0(CO2) ∙ r(RO2) + lgπ0(H2O) ∙ r(H2O) + lgπ0(N'2) ∙ r(R2).
4. Теперь можно построить кривые энтальпии и логарифма относи
тельного давления для продуктов сгорания при α=1 и для воздуха в
функции температуры, откладываемой по горизонтальной оси диаграм
мы. Интервал между кривыми энтальпии следует разделить на 10 (или
20) частей и соответствующие точки деления соединить плавными кри
выми. Эти кривые будут соответствовать продуктам сгорания, содержа
щим 90, 80, 70,..., 10% (или 95, 90, 85; 80;..., 5%) воздуха по объему
(если счет вести от кривой для воздуха).
Аналогичным образом можно построить промежуточные кривые логарифма относительного давления [2].
5. Для удобства пользования диаграммой остается нанести:
а) прямую µRТ в функции температуры, причем для этого доста
точно определить значения µRT [µR = 8,31441 кДж/(кмоль-К) для
двух-трех температур];
б) кривую зависимости rв от α. Для построения этой кривой необ
ходимо найти значения rв для α = 2, 3,.... 15 по формуле
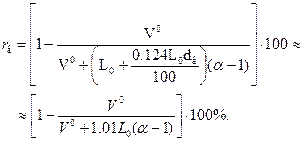
Например, при α = 6 для газа подземной газификации
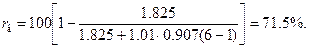
По найденным значениям rв в зависимости от α следует построить в удобном масштабе кривую, откладывая α по горизонтальной оси (см. диаграмму для газа подземной газификации, представленную на рис. 4);
в) кривую или шкалу логарифмов чисел lg φ ее следует строить в
том же масштабе, что и для логарифмов относительных давлений;
г) две прямые для определения молекулярной массы µ и плотности
газообразного продукта сгорания, отнесенной к нормальным условиям,
ρ, кг/м3.
Для построения этих прямых нужно определить µ продуктов сгорания при α=1 по найденному выше составу, пользуясь формулой
µпр.с = 44,01∙r(СО2)+ 18,016r(Н2O)+ 28,15r(N'2)
(при расчете данных для построения диаграммы следует принимать значения H и lgπ0 для атмосферного азота, молекулярная масса которого µ=28,15). В нашем случае
µпр.с = 44,01 ∙ 0,1704+ 18,016 ∙ 0,1211 + 28,15 ∙ 0,7085= 29,62;
молекулярная масса влажного воздуха µ = 28,86.
Отложив в удобном масштабе по горизонтали значения молекулярных масс, нанесем две точки: одну, соответствующую молекулярной массе воздуха при rв=100%, и другую, соответствующую молекулярной массе продукта сгорания, рассчитанной выше при rв = 0 (α=1). Соединив эти точки прямой, можем определить молекулярную массу продукта сгорания при любом rв, т. е. при любом значении α.
Аналогично строим кривую ρ.
В удобном масштабе по горизонтали откладываем значения р и наносим две точки: одну, соответствующую ρ воздуха (ρв=µв/22,4146 = = 28,86/22,4146=1,288 кг/м3) и другую, соответствующую ρ продуктов сгорания при α=1 (ρпр.с = 29,62/22,4146= 1,322 кг/м3).
Соединив эти точки, получим прямую для определения р продуктов сгорания данного топлива при любом избытке воздуха.
Следует отметить, что диаграмма для продуктов сгорания данного топлива при любом избытке воздуха может быть построена не на 1 кмоль, а на 1 кг газа. Для этого необходимо только определить энтальпию на 1 кг продукта сгорания топлива при α=1 и 1 кг влажного воздуха (разделить мольную энтальпию газа на соответствующую молекулярную массу) и в качестве параметра принять не объемное содержание воздуха в продуктах сгорания при данном избытке воздуха, а массовую его долю. Логарифм относительного давления не изменится, а построение диаграммы останется таким же, как и для моля газа.
 2015-10-13
2015-10-13 682
682








