При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия К данной системы:
Vпр =k1[CO][H2O]; Vобр = k2 [CO2][H2];
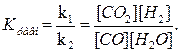
В условии задачи даны исходные концентрации, тогда как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2] = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
| Вещества | СО | Н2О | СО2 | Н2 |
| Сисход, моль/л | - | - | ||
| Прореагировало и образовалось | х | х | х | х |
| Сравн, моль/л | (3-х) | (2-х) | х | х |
Зная константу равновесия, находим значение х, а затем и равновесные концентрации всех веществ:
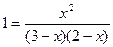 ;
;
х2 = 6 – 2х – 3х + х2; 5х = 6; х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[CO2] = 1,2 моль/л;
[H2] = 1,2 моль/л;
[CO] = 3 – 1,2 = 1,8 моль/л;
[H2О] = 2 – 1,2 = 0,8моль/л.
|
|
|
Пример 4. При некоторой высокой температуре константа равновесия Кс газовой реакции равна 4. Н2(г) + I2(г) ↔ 2HI(г).
Определить выход НI, если для реакции взято 4 моль/л водорода и 3 моль/л йода.
Решение.
Искомый выход, т.е. равновесную концентрацию HI, обозначим через х. Дальнейший ход решения тот же, что и в предыдущей задаче.
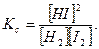
| Вещества | Н2 | I2 | HI |
| Сисход, моль/л | |||
| Прореагировало и получилось | 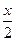
| 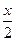
| x |
| Сравн, моль/л | 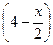
| 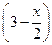
| x |
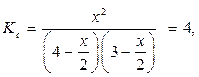 отсюда х=3,5 моль/л.
отсюда х=3,5 моль/л.
Пример 5. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
 РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрации, чтобы сместить равновесие в сторону прямой реакции - разложения РСl5?
 2015-10-14
2015-10-14 402
402








