Молекулярные растворы – это растворы, в которых растворимым веществом является неэлектролит.
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся понижение давление пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотическое давление.
Согласно закону Рауля, давление пара растворителя P 1 над растворомпропорционально мольной доле растворителя χ 1 в растворе: Р 1 = Р 10 χ1, где Р 10– давление пара чистого растворителя при данной температуре.
Для бинарного раствора закон Рауля можно представить в следующем виде: 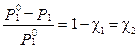 , то есть относительное понижение давления пара растворителя над раствором равно мольной доле X 2 растворенного вещества.
, то есть относительное понижение давления пара растворителя над раствором равно мольной доле X 2 растворенного вещества.
Если оба компонента раствора летучи, то закон Рауля выполняется для каждого из компонентов: Р 1 = Р 10 χ1 и Р 2 = Р 20 χ2
Общее давление пара над раствором равно сумме парциальных давлений P 1 и P 2:
P = P 1 + P 2 = Р 10 χ1 + Р 20 χ2 = Р 20 +(Р 10- Р 20)χ1, то есть давление пара линейно зависит от состава раствора.
В идеальных растворах закон Рауля выполняется для обоих компонентов во всем интервале составов.
Понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем:
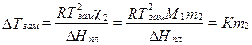 и
и 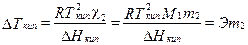 ,
,
где m 2 – моляльность раствора, K и Э – криоскопическая и эбулиоскопическая постоянные растворителя, χ2 – мольная доля растворенного вещества, Δ H пл. и Δ H кип. – энтальпии плавления и испарения растворителя, T пл. и T кип. – температуры плавления и кипения растворителя, M 1 – молярная масса растворителя.
 2015-10-22
2015-10-22 1464
1464
