С повышением температуры энтропия возрастает. Действительно, по мере увеличения температуры становится возможным все большое число состояний, так как молекулы могут переходить в состояние со более высокими значениями энергии, что приводит к увеличению термодинамической вероятности.
На рис. 3.4 показан характер зависимости энтропии вещества от температуры. В пределах одного фазового состояния изменение энтропии при изменении температуры незначительно, но при фазовом переходе (ф.п.) вещества (из твердого состояния в жидкое, из жидкого в газообразное состояние) энтропия вещества скачкообразно возрастает, что связано с переходом в состояние с большей неупорядоченностью.
Уравнение температурной зависимости энтропии моля вещества в пределах одного фазового состояния:
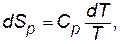
 (3.12)
(3.12)
где Ср – мольная теплоемкость при р = const.
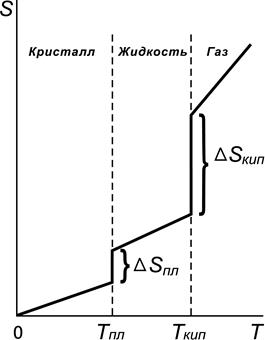
Рис. 3.4. Зависимость энтропии вещества от температуры
Принимая Ср = const в интервале температур Т 1и Т 2 получаем
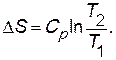 (3.13)
(3.13)
При температуре, равной абсолютному нулю, тепловое движение отсутствует, все атомы в идеальном кристалле занимают строго определенные места в пространстве. Такое состояние системы может быть реализовано единственным способом, поэтому при этом W =1, а S =0. Это третий закон термодинамики, называемый также постулатом Планка.
 2015-10-22
2015-10-22 10156
10156
