Второй закон термодинамики устанавливает критерии необратимости термодинамических процессов и вводит новую термодинамическую функцию – энтропию.
Энтропия S – функция состояния, которая обладает следующим свойством: 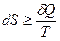 , где знак равенства относится к обратимым процессам, а знак больше - к необратимым.
, где знак равенства относится к обратимым процессам, а знак больше - к необратимым.
Для изолированных систем dS ≥ 0, т.е. энтропия в изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0, d 2 S < 0).
Энтропию можно определить с помощью двух эквивалентных подходов – статистического и термодинамического. Статистическое определение основано на идее о том, что необратимые процессы в термодинамике вызваны переходом в более вероятное состояние, поэтому энтропию можно связать с вероятностью: S=klnW, где k = 1,38·10-23 Дж/К – постоянная Больцмана (k = R / N A), W - так называемая термодинамическая вероятность, т.е. число микросостояний, которые соответствуют данному макросостоянию системы.
Термодинамическое определение энтропии основано на рассмотрении обратимых процессов: 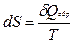 .
.
Расчет изменения энтропии для различных процессов:
1) Нагревание или охлаждение при постоянном давлении. 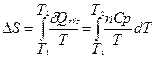
Если теплоемкость не зависит от температуры в интервале от T 1 до T 2, то 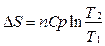 .
.
2) Изотермическое расширение или сжатие. 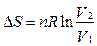
3) Фазовые переходы. При обратимом фазовом переходе температура остается постоянной, а теплота фазового перехода при постоянном давлении равна Δ H ф.п., поэтому изменение энтропии равно: 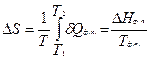
4) Смешение идеальных газов при постоянных температуре и давлении.
Если n 1 моль одного газа, занимающего объем V 1, смешиваются с n 2 моль другого газа, занимающего объем V 2, то общий объем будет равен V 1 + V 2, причем газы расширяются независимо друг от друга и общее изменение энтропии равно сумме изменений энтропии каждого газа:
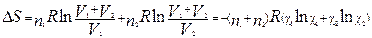 , где xi - мольная доля i -го газа в полученной газовой смеси.
, где xi - мольная доля i -го газа в полученной газовой смеси.
В отличие от многих других термодинамических функций, энтропия имеет точку отсчета, которая задается постулатом Планка (третьим законом термодинамики):
При абсолютном нуле T = 0 К все идеальные кристаллы имеют одинаковую энтропию, равную нулю.
Постулат Планка позволяет ввести понятие абсолютной энтропии вещества, т.е. энтропии, отсчитанной от нулевого значения при T = 0. Для расчета абсолютной энтропии веществ в стандартном состоянии надо знать зависимости теплоемкости Cp от температуры для каждой из фаз, а также температуры и энтальпии фазовых переходов. Так, например, абсолютная энтропия газообразного вещества в стандартном состоянии при температуре T складывается из следующих составляющих: 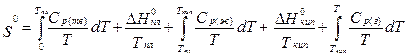
В термодинамических таблицах обычно приводят значения абсолютной энтропии в стандартном состоянии при температуре 298 К.
Значения абсолютной энтропии веществ используют для расчета изменения энтропии в химических реакциях: 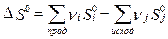 .
.
 2015-10-22
2015-10-22 3573
3573
