В термодинамике под фазой понимают совокупность частей термодинамической системы, одинаковых по всем физическим и химическим свойствам.
Различными фазами, в частности, являются агрегатные состояния какого-либо вещества: газообразное, жидкое, твердое. Так, различные фазы воды - это пар, жидкая вода и лед, причем каждая кристаллическая форма льда образует особую фазу.
Необходимо подчеркнуть, что, говоря о твердом состоянии как об особой фазе вещества, имеют в виду лишь твердое кристаллическое состояние, характеризующееся правильным расположением атомов, образующих пространственную решетку, в этом проявляется так называемый дальний порядок. Аморфные тела не имеют кристаллической решетки, их относят к переохлажденным жидкостям.
Кроме дальнего порядка, у атомов твердого тела имеется ближний порядок, проявляющийся в том, что у каждого атома в зависимости от его сорта в виде кристаллической решетки всегда имеется определенное число ближайших соседних атомов. Таким образом, в отличие от жидкостей, молекулам которых присущ ближний порядок, у атомов твердого тела имеются ближний и дальний порядки. Обычно кристаллические твердые тела существуют в виде поликристаллов, таковы, например, все металлы.
Процессы, при которых вещество переходит из одной фазы в другую, называются фазовыми переходами.
Различают фазовый переход первого и второго рода. Фазовые превращения, сопровождающиеся поглощением или выделением теплоты, называют фазовыми переходами первого рода. Такой переход всегда изотермичен, при чем температура перехода зависит от давления. Типичными фазовыми переходами первого рода являются испарение жидкости, плавление твердого тела и обратные им процессы.
Фазовыми переходами второго рода называют переходы, не связанные с поглощением или выделением теплоты. Примером такого перехода может служить превращение ферромагнетика в парамагнетик в точке Кюри.
В данной работе изучается фазовый переход первого рода на примере процессов плавления и кристаллизации.
Если кристаллическому телу сообщить тепло, то вначале температура тела будет расти за счет увеличения колебательной энергии частиц. При этом амплитуда колебаний увеличивается и объем тела растет. Происходит тепловое расширение кристаллов.
При определенной температуре амплитуды колеблющихся частиц становятся соизмеримыми с расстояниями между частицами в кристаллической решетке. Сообщаемое телу тепло идет на разрушение кристаллической решетки, нарушается дальний порядок расположения частиц, и вещество переходит в жидкое состояние, характеризующееся ближним порядком. Свойства вещества меняются скачкообразно.
Процесс перехода вещества из твердого состояния в жидкое называется плавлением. Процесс плавления происходит при постоянной для данного давления температуре и соответствует одновременному существованию твердой и жидкой фазы. Количество тепла, необходимое для превращения единицы массы твердого тела в жидкость при температуре плавления, называется удельной теплотой плавления. В отличие от кристаллов при нагревании твердых аморфных тел не наблюдается скачкообразного изменения свойств. В определенном интервале температур происходят постепенное размягчивание тел, т.e. по существу аморфные твердые тела и жидкости различаются лишь степенью подвижности частиц. Таким образом, аморфные тела не имеют определенной температуры плавления. Когда процесс плавления кристаллического тела заканчивается и все вещество перейдет в жидкое состояние, температура начнет снова повышаться. Ход кривой нагревания твердого тела в зависимости от времени показан на рис.1.
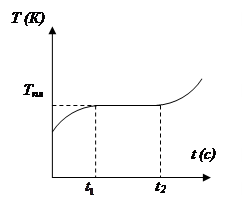
|
Постепенно переходы от одного положения равновесия к другому прекращаются и ближний порядок расположения частиц переходит в дальний. Процесс кристаллизации происходит при постоянной температуре, равной температуре плавления. При образовании кристаллической решетки выделяется теплота, при этом удельная теплота кристаллизации равна удельной теплоте плавления.
Поскольку фазовый переход 1-го рода связан с поглощением или выделением некоторого количества теплоты, то в точке перехода происходит скачкообразное изменение величин, характеризующих тепловое состояние тела.
Каждое состояние системы можно рассматривать как с макроскопической точки зрения так и с микроскопической. С макроскопической точки зрения состояние тела определяется
совокупностью макропараметров: объем, температура, давление. При этом макропараметры получаются в результате усреднения соответствующих величин, характеризующих отдельные молекулы. Например, абсолютная температура определяется средним значением кинетической энергии поступательного движения молекулы, а давление - средней силой взаимодействия молекул со стенками сосуда. В результате теплового движения скорости и координаты отдельных молекул со временем изменяется, но среднее значение скорости молекул при достижении системой равновесия остается постоянным. Значит, одно и то же макросостояние (одни и те же Р, V, Т) можно реализовать различными способами или, говорят, различными микросостояниями.
Вообще, любое макроскопическое состояние системы с определенными значениями параметров представляет собой непрерывную смену близких микросостояний, отличающихся друг от друга распределением одних и тех же молекул по координатам и скоростям. Количество таких непрерывно сменяющих друг друга микросостояний, реализующих данное макросостояние, прямо связано со степенью беспорядочности этого макросостояния.
Распределение молекул в пространстве также, как и распределение их скоростей - явления случайные. Но при заданных условиях (Р, V, T) то или иное распределение характеризуется определенной математической вероятностью. В статистической физике для определения вероятности реализации определенного состояния системы пользуются понятием статистического веса или термодинамической вероятности W. Термодинамической вероятностью называют число микрораспределений молекул по координатам и скоростям, соответствующих данному макросостоянию.
Термодинамическая вероятность W характеризует степень внутреннего беспорядка в системе. Состояние, полностью упорядоченное, осуществляется единственным образом и имеет минимальное значение W = 1. Равновесное состояние
системы является наиболее вероятным и потому термодинамическая вероятность равновесного состояния максимальна.
Всякий естественный процесс развивается так, что замкнутая система переходит из менее вероятного состояния в более вероятное, так, что степень беспорядка в ней увеличивается: температуры тел сами собой выравниваются, газы перемешиваются, устанавливается равновесие. Значит, с помощью термодинамической вероятности можно характеризовать направление процессов: в замкнутой системе возможны лишь такие процессы, при которых степень беспорядка не уменьшается.
Другой величиной, которая также указывает на направление процессов, является энтропия S (в переводе на русский язык энтропия - способность к превращению). Количественную связь между энтропией и термодинамической вероятностью установил в 1875 г. Больцман.
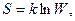
где к - постоянная Больцмана.
Энтропия S также как и термодинамическая вероятность характеризует степень беспорядка в системе и является функцией состояния системы, т.е. ее изменение 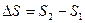 не зависит от пути перехода из состояния I в состояние II.
не зависит от пути перехода из состояния I в состояние II.
Найдем изменение энтропии системы при переходе ее из одного состояния в другое.
Пусть идеальный газ находится при постоянной температуре и расширяется в пустоту. Тогда распределение по скоростям, согласно закону Максвелла, не меняется и, как показывает точный статистический расчет, число распределений N молекул по объему
Следовательно, 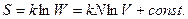
При расширении газа в пустоту энтропия системы изменится
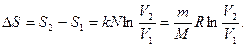 (1)
(1)
Так как 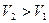 , то
, то 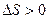 , т.е. энтропия увеличилась.
, т.е. энтропия увеличилась. 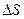 - есть количественная мера возрастания беспорядка в системе, увеличение степени хаотичности в ней.
- есть количественная мера возрастания беспорядка в системе, увеличение степени хаотичности в ней.
Расширение газа в пустоту - процесс необратимый, и энтропия при протекании такого процесса возросла.
Такого же изменения объема можно было добиться в результате изотермического процесса, но при этом системе надо сообщить количество тепла
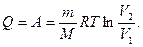 (2)
(2)
Сравнивая (1) и (2), находим
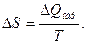
Этот результат Клаузиус записал в виде
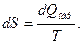
Т.е. возрастание энтропии системы численно равно количеству тепла, сообщенного телу в элементарном квазистатическом (обратимом) процессе, деленному на абсолютную температуру тела.
Подчеркнем, что, вычисляя изменение энтропии при любом реальной переходе из одного состояния в другое, мы должны "совершать мысленно" переход обратимо, и полученный результат будет верен, каким бы ни был реальный переход. Это возможно сделать потому, что энтропия есть функция состояния и не зависит от пути перехода в это состояние.
Понятие энтропии позволяет сформулировать закон, указывающий направление процессов в замкнутой системе (II начало термодинамики): Энтропия замкнутой системы не может убывать: 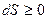 .
.
Для фазовых переходов первого рода изменение энтропии можно рассчитать по формуле Клаузиуса:
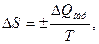
где 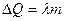 (
(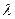 - удельная теплота плавления, m - масса тела);
- удельная теплота плавления, m - масса тела);
T – температура фазового перехода по шкале Кельвина.
Знак плюс соответствует поглощению телом количества теплоты (плавлению), знак минус - кристаллизации, которая сопровождается выделением теплоты.
Таким образом, при плавлении твердого тела изменение его энтропии положительно. Это показывает, что энтропия жидкости больше, чем твердого тела: 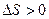 . Сообщение телу тепла приводит к усилению теплового движения его атомов, т.е. к увеличению хаотичности движения, а тем самым - к увеличению статистического веса.
. Сообщение телу тепла приводит к усилению теплового движения его атомов, т.е. к увеличению хаотичности движения, а тем самым - к увеличению статистического веса.
 2015-07-21
2015-07-21 4291
4291
