Удельная энтропия смеси S см, Дж / (К · кг), определяется по следующей формуле:
 ,где:
,где: 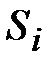 - энтропия 1 кг i -го газа.
- энтропия 1 кг i -го газа.
Из курса общей термодинамики известно:
 ,
,
где:  - массовая изобарная теплоемкость i -го газа.
- массовая изобарная теплоемкость i -го газа.
Окончательно удельная энтропия  -компонентной смеси вычисляется по следующей формуле:
-компонентной смеси вычисляется по следующей формуле:
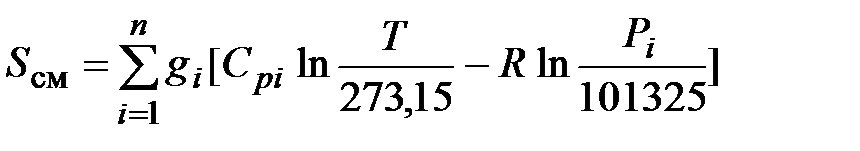
Теплоемкость газовой смеси
Т. к. температура всех газов в смеси одинакова, то теплоемкость смеси, складывается из теплоемкостей всех компонентов, взятых в долях, соответствующих способу задания смеси:
 - массовая (удельная) теплоемкость, Дж / (кг·К);
- массовая (удельная) теплоемкость, Дж / (кг·К);
 - мольная теплоемкость, Дж / (кмоль·К);
- мольная теплоемкость, Дж / (кмоль·К);
 - объемная теплоемкость, Дж / (м3·К).
- объемная теплоемкость, Дж / (м3·К).
где: 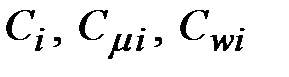 - массовая, мольная и объемная теплоемкости i -го компонента.
- массовая, мольная и объемная теплоемкости i -го компонента.
СМЕШЕНИЕ ГАЗОВ
Пусть смешиваются n химически невзаимодействующих между собой идеальных газов. Предполагается, что известны начальные термодинамические параметры состояния всех компонентов до смешения и условия смешения (условия взаимодействия с окружающей средой). Требуется найти равновесные параметры состояния газов после смешения.
Рассмотрим два случая смешения, для простоты полагая, что этот процесс идет без теплообмена с окружающей средой.
22.5.1. Смешение при W=Const
В этом случае условия смешения таковы, что объем образующейся смеси Wсм равен сумме начальных объемов компонентов смеси WHi:
 .
.
(Не следует путать WHi с парциальными объемами Wi)
Обозначим: РHi – начальное давление i -го газа; ТHi, tHi – начальная температура i -го газа соответственно в 0 К или 0 С.
Можно получить формулу для температуры смеси газов в градусахЦельсия:

В знаменателе формулы содержатся средние теплоемкости, у которых в качестве верхнего предела осреднения используется температура смеси t, подлежащая определению. В силу этого, температура смеси по этой формуле определяется методом последовательных приближений.

22.5.1. Частные случаи смешения газов при W=Const
- Пусть смешиваются газы, у которых зависимостью показателя адиабаты Кi от температуры можно пренебречь.
(В действительности К убывает с ростом температуры, т. к.
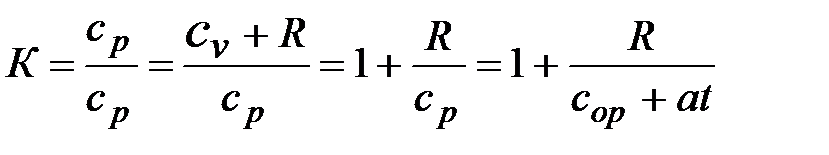
где со р , а – эмпирические положительные коэффициенты.
Для технических расчетов в диапазоне от 0 до 20000С можно пользоваться следующими формулами:
а) для двухатомных газов К 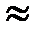 1,40 - 0,50 10-4 t;
1,40 - 0,50 10-4 t;
б) для продуктов сгорания К 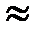 1,35 - 0,55 10-4 t.
1,35 - 0,55 10-4 t.
Из этих формул видно, что влияние температуры на показатель адиабаты К становится заметным лишь при температурах, порядка сотен градусов по шкале Цельсия.)
Т. о., если допустить, что
то  ,
,
: 
Эту формулу можно использовать в качестве первого приближения для точной формулы.
- Пусть смешиваются газы, у которых мольные изохорные теплоемкости равны и зависимостью этих теплоемкостей от температуры можно пренебреч ь, т. е.:

 .
.
Тогда:

22.5.2. Давление после смешения газов при W=Const
Давление, устанавливающееся после смешения газов, можно определить по формулам:

Или

Для частного случая 2 давление смеси:
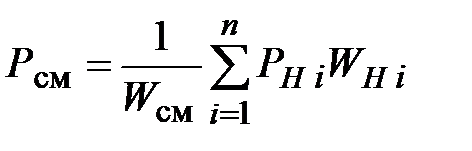
 2018-01-21
2018-01-21 3120
3120
