От температуры. Уравнение Аррениуса
В большинстве случаев скорость химической реакции увеличивается при повышении температуры.
Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса
 , , | (4.12) |
где k – константа скорости реакции; А – константа, называемая предэкспоненциальным множителем;  – основание натурального логарифма; Е a – энергия активации, Дж / моль; Т – температура, К;
– основание натурального логарифма; Е a – энергия активации, Дж / моль; Т – температура, К;
R – газовая постоянная, Дж / моль × К.
Энергия активации
Энергия активации в элементарных реакциях – минимальная энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в химическую реакцию, т.е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный барьер – максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения.
В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования необходима энергия активации (рис. 4.3).
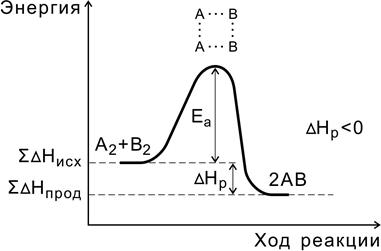
Рис. 4.3. Энергетическая диаграмма экзотермической реакции
Число частиц, входящих в активированный комплекс, определяет молекулярность данной стадии реакции.
Неустойчивый активированный комплекс существует очень короткое время ( ). Он распадается с образованием исходных веществ или продуктов реакции.
). Он распадается с образованием исходных веществ или продуктов реакции.
Переходное состояние возникает в ходе как прямой, так и обратной реакций. Разность энергий активации прямой и обратной реакций равна изменению внутренней энергии (тепловому эффекту) реакции
D Н р = Е а(пр) – Е а(обр).
 2015-10-22
2015-10-22 922
922








