Например, выражение для константы равновесия следующей реакции
СО2 (г) + С(тв) «2СО(г)
записывается так:

 .
.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ  , и константа равновесия, выраженная через равновесные парциальные давления
, и константа равновесия, выраженная через равновесные парциальные давления  (см. «Основы химической термодинамики»), связаны между собой соотношениями
(см. «Основы химической термодинамики»), связаны между собой соотношениями



где Dn - изменение числа газообразных молей в реакции.
Стандартное изменение энергии Гиббса равно
 ,
,
а также
 .
.
После приравнивания правых частей уравнений
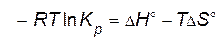
или
 . . | (4.21) |
Уравнение (4.21) не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций реагентов (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов.
Смена механизма, например, при введении катализатора, не влияет на численное значение константы равновесия, но может изменить скорость достижения равновесного состояния.
|
|
|
4.14.3. Смещение химического равновесия.
Принцип Ле Шателье. Истинное химическое равновесие является динамическим и подвижным: изменение внешних условий (температуры, давления, концентраций реагирующих веществ) ведет к смещению равновесия в сторону прямой или обратной реакции. Характер влияния внешних факторов на равновесные системы выражает принцип Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия.
 2015-10-22
2015-10-22 2705
2705
