Методы расчета состава равновесной реакционной смеси и
Химические реакции идут в сторону установления динамического равновесия, при котором в системе присутствуют и исходные вещества и продукты реакции, но отсутствует тенденция к изменению достигнутого состояния. Для некоторых реакций концентрации продуктов в равновесной смеси настолько превышают концентрации непрореагировавших исходных веществ, что с практической точки зрения реакция «завершается». Однако в большинстве случаев равновесная смесь содержит сопоставимые количества реагентов и продуктов реакции, поэтому одной из важнейших прикладных задач является расчет состава равновесной реакционной смеси и равновесного выхода продукта.
Пример 1. Расчет состава равновесной смеси для гомогенной реакции, протекающей в газовой фазе.
Пусть требуется найти состав равновесной смеси для реакции:
H2 + I2 = 2 HI,
в которой сумма стехиометрических коэффициентов в правой и левой частях уравнения одинакова (в данном случае равна ∆n = 2). Для реакций такого типа KP=Kx=Kc. Допустим, что число молей каждого из исходных веществ на момент начала реакции, равно его стехиометрическому множителю в уравнении реакции. Обозначим за х – число молей продукта HI, образовавшихся к моменту установления равновесия.
Если в начальный момент времени в системе присутствовали только реагенты, то:
| Число молей веществ | H2 | + | I2 | = | 2 HI |
| в исходном состоянии: | - | ||||
| прореагировало или образовалось: | -x | -x | 2x | ||
| в равновесной смеси: | 1 - х | 1 - х | 2x | ||
| суммарное число моль: | (1 – х) + (1 – х) + 2х = 2 | ||||
Выразим равновесное парциальное давление каждого компонента в соответствии с законом Дальтона 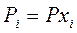 | 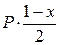 | 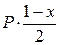 | 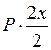  |
Константа равновесия этой реакции в соответствии с составленным равновесием будет выражена уравнением:
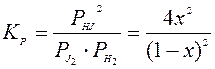 .
.
Решая полученное квадратное уравнение при заданных Р и КР, определяем физически корректное значение x, а, значит, и равновесный состав смеси. Очевидно, что в рассматриваемом случае выход продукта не зависит от давления.
Пример 2. Расчет состава равновесной смеси для гомогенной реакции, протекающей в газовой фазе с изменением числа молей реагентов.
Рассмотрим реакцию:
N2 + 2CH4 = 2HCN + 3H2 ,
для которой сумма стехиометрических коэффициентов в правой и левой частях уравнения различна (в данном случае ∆n = 5 – 3 = 2). Если в начальный момент времени в системе присутствовали только реагенты, то:
| Число молей: | N2 | + | 2CH4 | = | 2HCN | + | 3H2 |
| в исходном состоянии: | - | - | |||||
| прореагировало (образовалось): | - х | - 2х | 2х | 3х | |||
| в равновесной смеси: | 1 - x | 2 - 2x | 2х | 3х | |||
| суммарное число моль: | 1 – x + 2 - 2x + 2x + 3x = 3 + 2x | ||||||
Выразим равновесное парциальное давление каждого компонента в соответствии с законом Дальтона 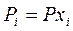 | 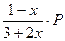 | 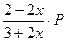 | 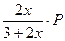 | 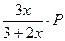 |
Константа равновесия этой реакции в соответствии с составленным равновесием будет выражена уравнением:
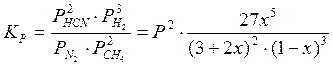 .
.
Решая полученное уравнение при заданных давлении и константе равновесия, находим значение x и равновесный состав смеси. При данной температуре константа равновесия есть величина постоянная, поэтому в рассматриваемом случае выход продукта зависит от общего давления P. Чем больше будет P, тем меньше значение x (тем меньше выход продукта). Полученный результат согласуется с правилом Ле Шателье - Брауна: возрастание давления должно приводить к смещению равновесия в сторону веществ, занимающих меньший объем.
Пример 3. Расчет состава равновесной смеси для гетерогенной реакции.
Химические реакции, в которых вещества находятся в разных фазах, называют гетерогенными реакциями. В тех случаях, когда конденсированная фаза является раствором, константа равновесия выражается через мольные доли (идеальный раствор) или через активности (реальный раствор). Газообразные реагенты будут представлены в константе равновесия парциальными давлениями (идеальные газы) или летучестями (реальные системы).
Если твердые вещества, участвующие в реакции, не образуют растворов, их концентрации (активности) равны 1 и не входят в выражение для константы равновесия. Таким образом, в константу равновесия гетерогенной реакции входят только парциальные давления газообразных участников реакции.
Рассмотрим реакцию:
C(тв) + CO2 = 2CO.
Условимся, что в реакцию вступают а молей углекислого газа, а продукт в исходной реакционной смеси отсутствует.
| Число молей веществ | C(тв) | + | CO2 | = | 2CO |
| в исходном состоянии: | - | а | - | ||
| прореагировало или образовалось: | - | - x | 2x | ||
| в равновесной смеси: | - | а - х | 2x | ||
| суммарное число моль: | а – х + 2х = а + х | ||||
Выразим равновесное парциальное давление каждого компонента в соответствии с законом Дальтона 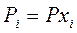 | - | 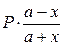 | 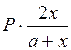  |
Константа равновесия этой реакции будет выражена уравнением:
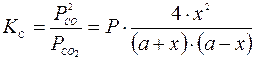 .
.
Решая полученное квадратное уравнение, находим значение выхода продукта x.
 2014-01-31
2014-01-31 1382
1382
