Английский ученый Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и массой веществ, подвергшихся электрохимическому превращению на электродах.
1−й закон Фарадея :масса вещества m, претерпевшего электрохимическое превращение на каждом из электродов, прямо пропорциональна количеству прошедшего через систему электричества Q:
m ~ Q. 

2−й закон Фарадея: массы веществ, претерпевших электрохимическое превращение при прохождении через систему одного и того же количестве электричества, пропорциональны их молярным массам химических эквивалентов M Э :
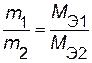 .
.
Из второго закона следует, что для электрохимического превращения 1 моль эквивалентов вещества требуется одинаковое количество электричества F = 96500 Кл (А∙с). Эта величина называется постоянной Фарадея. Значение постоянной Фарадея F можно рассчитать, исходя из того, что один моль эквивалентов вещества содержит 6,02  1023 (постоянная Авогадро), элементарных зарядов, а элементарный заряд равен 1,602
1023 (постоянная Авогадро), элементарных зарядов, а элементарный заряд равен 1,602  10-19 Кл.
10-19 Кл.
Отсюда F =6,02  1023
1023  1,602
1,602  10-19 ≈ 96500 Кл/моль экв.
10-19 ≈ 96500 Кл/моль экв.
 2015-10-22
2015-10-22 1405
1405








