Природа химической связи.
Химическая связь - это совокупность сил, удерживающих между собой два или несколько атомов или ионов. Природой таких сил могут быть:
1. Электростатические взаимодействия разноименно заряженных частиц;
2. Взаимодействия, связанные с перераспределением электронной плотности при образовании молекул;
3. Дипольные взаимодействия, или силы Ван-дер –Ваальса
Типы химической связи.
По характеру распределения электронной плотности между взаимодействующими атомами различают ионный, ковалентный и металлический типы химических связей (Рис 1).
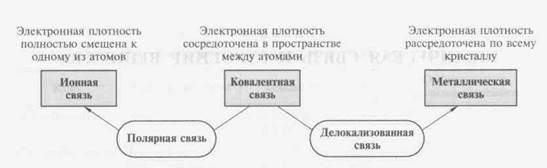
Рис 1. Основные типы химической связи
Ионная связь образуется между наиболее электроотрицательными элементами и определяется энергией (Екулон) кулоновского взаимодействия между ионами с зарядами q1 м q2
Екулон = 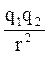 ,
,
где r – расстояние между ионами. Она характерна для ионных кристаллов, например, газообразного фторида натрия NaF, твердого хлорида натрия NaCi.
Ковалентная связь анализируется с помощью методов валентной связи (МВС) и молекулярных орбиталей (ММО), которые рассматриваются ниже. При смещении электронной плотности к одному из атомов возникает полярная связь, а при полной ее делокализации- металлическая связь (Рис. 1).
Металлическая связь реализуется в металлах с помощью «электронного газа», т.е. электронов, не принадлежащих какому-то атому, а делокализованных по всему кристаллу. В отличие от ковалентной она является ненаправленной и ненасыщенной.
При сближении молекул также возникает химическая связь, обусловленная так называемыми силами Ван-дер-Ваальса. Для них известны три типа:

 2015-10-22
2015-10-22 395
395







