С помощью энергетических диаграмм МОо свойствах молекул можно оценить кратность (порядок) связи. Порядок(кратность КС) связи = (число электронов на связывающей орбитали – число электронов на разрыхляющей орбитали) / 2. Величина КС коррелирует со следующими свойствами молекул:
а) прочностью (энергией диссоциации);
б) межатомными расстояниями;
в) магнитными свойствами молекул (если на МО имеются неспаренные электроны, то молекулы парамагнитны, а если все электроны спарены, то молекулы диамагнитны);
г) потенциалом ионизации, который равен по модулю энергии верхней заполненной МО.
д) спектральными характеристиками (спектрами поглощения и испускания) молекул.
В качестве примера рассмотрим с помощью этих правил некоторые свойства H2+, H2 и H2- (Рис. 3). Кратность связи (КС) для ионов H2+ и H2- одинакова, но появление электрона на разрыхляющей орбитали в ионе H2- приводит к уменьшению электронной плотности, энергии связи и соответственно увеличению расстояния между атомами водорода. Для молекулы Н2 соответствующие величины указаны в центре рис. 3
|
|
|

Рис. 3 Энергетические диаграммы и свойства H2+, H2 и H2-
§ 6. Энергетическая схема МО молекулы фтора F2.
Рассмотрим энергетическую диаграмму более сложной молекулы, а именно, молекулы фтора.
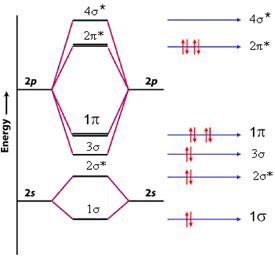
Рис.4 Энергетическая диаграмма МО молекулы фтора.
Энергетические АО фтора (2s- и 2p-) располагаются по обе стороны от диаграммы молекулярных орбиталей. σ- молекулярные орбитали образуются при перекрывании 2s- и 2pz - АО которые имеют цилиндрическую симметрию относительно оси, соединяющей ядра (обычно её принимают за ось z). Из четырёх атомных орбиталей (2s- и 2pz) можно сконструировать четыре МО: две связывающие (1σ + 3σ) и две разрыхляющие (2σ* + 4σ*) молекулярные орбитали. Оставшиеся две 2px-  и 2py- АО каждого атома фтора перекрываются (интерферируют) с образованием двух (1π-) связывающих и двух разрыхляющих (2π*) молекулярных орбиталей. Каждая из этих двух пар имеет одинаковую энергию, и поэтому они называются вырожденными. Для завершения построения диаграммы необходимо рассмотреть распределение 14 электронов (7 от одного атома фтора и 7 от другого) по энергетическим уровням МО, что показано в правой части Рис 4.
и 2py- АО каждого атома фтора перекрываются (интерферируют) с образованием двух (1π-) связывающих и двух разрыхляющих (2π*) молекулярных орбиталей. Каждая из этих двух пар имеет одинаковую энергию, и поэтому они называются вырожденными. Для завершения построения диаграммы необходимо рассмотреть распределение 14 электронов (7 от одного атома фтора и 7 от другого) по энергетическим уровням МО, что показано в правой части Рис 4.
Свойства: кратность связи, прочность (энергия диссоциации), межатомное расстояние, магнитные свойства, энергия ионизации и электронная конфигурация молекулы фтора приведены в табл.1
§ 7 Энергетические диаграммы МО молекул элементов второго периода
У элементов второго периода при переходе от лития к фтору происходит изменение энергий МО двухатомных молекул. Сопоставим сначала энергетические диаграммы МО молекул фтора и азота (Рис 5). Они подобны за исключением того, что в молекуле азота 3σ- орбитали расположены по энергии выше, чем 1π-орбитали, а в молекуле фтора, наоборот, энергия 1π-орбитали оказывается больше энергии 3σ- орбитали. Почему это так?- При переходе от лития к фтору увеличивается различие энергий 2s- и 2р- атомных орбиталей (см лекцию 10 Строение атома).
|
|
|

Рис 5. Энергетические диаграммы МО молекул азота (справа) и фтора (слева)
Вследствие этого σ- взаимодействие 2s- и 2р- атомных орбиталей ослабевает и у фтора практически отсутствует. У азота разница в энергиях 2s- и 2р- атомных орбиталей существенно меньше, и в формировании 1π- и 3σ- молекулярных орбиталей принимают участие не только 2р-, но и 2s-АО, т.е. увеличиваются коэффициенты сi в уравнении (1). В результате энергия 3σ- орбиталей оказывается выше (менее выгодной) энергии 1π- орбиталей. Этот факт можно ещё объяснить и значительным отталкиванием 1σ- 3σ- МО в молекуле азота и его уменьшением при переходе к молекуле фтора из- за большой разницы в энергиях 2s- и 2р- атомных орбиталей.
Закономерности в изменении энергий МО и свойств двух -атомных молекул 2-ого периода представлены в табл 1
Таблица 1. Электронные конфигурации и свойства двухатомных молекул
элементов 2-ого периода

.Отметим две важные особенности. Во-первых, в молекуле кислорода на
2 π* разрыляющей МО имеются два неспаренных электрона. Это обуславливает парамагнетизм молекулы кислорода, что не может обьяснить метод валентной связи. Во-вторых, потенциал энергии ионизации молекулы азота выше, чем в атоме азота. У фтора же, наоборот, потенциал ионизации молекулы ниже, чем у атома. Почему?- Дело в том, что в молекуле азота верхней заполненной МО, с которой и должен оторваться электрон, является 3σ- МО, а в молекуле фтора 2π-МО, энергия которой больше, чем у атома фтора.
 2015-10-22
2015-10-22 5458
5458
