Среди различных подходов к объяснению образования комплексного иона наиболее общий дает метод молекулярных орбиталей. Впервые к комплексным соединениям он был применен Ван-Флеком в 1935 г. При описании координационной связи в комплексном ионе в методе молекулярных орбиталей учитываются не только вакантные атомные орбитали иона-комплексообразователя, что характерно для метода валентных связей, но и орбитали, координирующихся вокруг комплексообразователя n лигандов. Формирование молекулярных орбиталей в комплексных соединениях осуществляется по тому же принципу, что и в простых бинарных молекулах. Отличие заключается в том, что в комплексном ионе молекулярные орбитали многоцентровые и делокализованные, как, например, в молекуле бензола или содержащих циклические ядра «сэндвичевых» комплексах – дибензолхроме [Cr(C6H6)2] и ферроцене [Fe(C5H5)2]. В последних примерах атомы металлов находятся между циклическими органическими структурами, энергия которых равномерно распределена (делокализована) по обоим циклам, в результате чего центральный атом в равной степени взаимосвязан со всеми атомами комплекса.
 Комплексные соединения известны практически для всех элементов таблицы Менделеева. f-элементам свойственна наивысшая комплексообразующая способность, но актиноиды и лантаноиды короткоживущие элементы. Поэтому среди стабильных элементов d-элементы, имеющие свободные орбитали на внешнем уровне и незавершенные предвнешние уровни, обладают наиболее высокой способностью к комплексообразованию, а их комплексы наиболее прочны. Среди комплексов d-элементов для жизнедеятельности человека наиболее важны природные соединения Mn, Fe, Co, Cu, Zn, Mo. Амфотерные р-элементы: Al, Sn, Pb и др., имеющие три р-орбитали, более слабые комплексообразователи. Комплексообразующая способность s-элементов самая малая, – более чем на порядок ниже, чем у p-элементов. Биогенные s-элементы Na, K, Ca, Mg могут образовывать непрочные комплексы только с лигандами определенной структуры. Таким образом, в блоках периодической системы способность к комплексообразованию уменьшается в следующем порядке: f > d > p >> s.
Комплексные соединения известны практически для всех элементов таблицы Менделеева. f-элементам свойственна наивысшая комплексообразующая способность, но актиноиды и лантаноиды короткоживущие элементы. Поэтому среди стабильных элементов d-элементы, имеющие свободные орбитали на внешнем уровне и незавершенные предвнешние уровни, обладают наиболее высокой способностью к комплексообразованию, а их комплексы наиболее прочны. Среди комплексов d-элементов для жизнедеятельности человека наиболее важны природные соединения Mn, Fe, Co, Cu, Zn, Mo. Амфотерные р-элементы: Al, Sn, Pb и др., имеющие три р-орбитали, более слабые комплексообразователи. Комплексообразующая способность s-элементов самая малая, – более чем на порядок ниже, чем у p-элементов. Биогенные s-элементы Na, K, Ca, Mg могут образовывать непрочные комплексы только с лигандами определенной структуры. Таким образом, в блоках периодической системы способность к комплексообразованию уменьшается в следующем порядке: f > d > p >> s.
Различия в комплексообразующей способности прослеживаются не только между элементами отдельных s, p, d, f-семейств периодической системы, но и между элементами одного семейства. Среди многообразия факторов, влияющих на комплексообразование, можно выделить несколько основных, прямо связанных с природой и строением иона комплексообразователя.
Для иона комплексообразователя, имеющего электронную конфигурацию инертного газа (s2 или ns2np6 – щелочные и щелочно-земельные металлы; многие элементы побочных подгрупп 3-8 групп, в высшей степени окисления), псевдоинертного ((n-1)d10 – Cu+, Ag+, Au+, Zn2+, Cd2+, Ga3+, In3+, Sn4+, Pb4+, Sb5+, Bi5+) или псевдоинертного газа плюс два электрона ((n-1)d10ns2 – Ga+, In+, Sn2+, Pb2+, Sb3+, Bi3+) комплексообразующая способность зависит главным образом от эффективного ионного радиуса и эффективного заряда ядра атома. Если отношение заряда катиона к его радиусу в кристалле принять за φ – ионный потенциал, то можно показать, что способность к образованию комплексных соединений ионами металлов с небольшими или многозарядными ионными и полидентатными лигандами увеличивается по мере возрастания ионного потенциала. Наблюдаемая последовательность для ионов с одним и тем же зарядом подтверждает такое предположение: Li+ > Na+ > K+ > Rb+ > Cs+; Mg2+ > Ca2+ > Sr2+ > Ba2+ > Ra2+; Al3+ > Sc3+ > Y3+ > La3+. Аналогичная закономерность свойственна ионам с различными зарядами, но примерно одинакового размера: Y3+ > Ca2+ > Na+; La3+ > Sr2+ > K+.
Несоответствие возникает при сравнении близких по размеру и заряду представителей одной и той же группы периодической системы, например: K и Cu+, Ca и Cd, Sc и Ga3+. Элементы побочной подгруппы всегда более сильные комплексообразователи, по сравнению с элементами главной, и причина этого кроется в различии электронных конфигураций. Ионы элементов главной подгруппы имеют конфигурацию инертного газа ns2np6, а ионы побочной – псевдоинертного (n-1)d10, либо псевдоинертного плюс два электрона (n-1)d10ns2. Последние конфигурации в меньшей степени экранируют заряд ядра положительного одноатомного иона, из-за чего эффективный заряд ядра для ионов элементов побочной подгруппы в действительности выше, чем для ионов элементов главной. Например, для иона Cu+ он больше, чем для иона K+.
Значение эффективного заряда можно найти по величинам энергий ионизации. Так, хотя Na+ и Cu+ почти одинаковы по размеру (0,95 и 0,93 Ǻ), энергия ионизации для Na+ равна 118,5 ккал/моль, а для Cu+ - 178 ккал/моль. Это различие связано с наличием у иона Cu+ большего сродства к электрону, что приводит к большему притяжению электронов лиганда к меди, чем к иону натрия.
Для ионов металлов с конфигурацией инертного газа, как s, p так и d-элементов, комплексообразование не является характерным. Несравненно более высокую комплексообразующую способность проявляют ионы переходных металлов, когда d-орбитали незаполнены – (n-1)d1-9. Это означает, что для формирования донорно-акцепторных связей, образования устойчивых комплексных соединений принципиальное значение имеет не только величина φ потенциала катиона, но и наличие, а также число свободных орбиталей на d-подуровне, которые могут быть «заселены» неподеленными парами электронов лиганда.
Значительное влияние на процесс комплексообразования оказывает расщепляемость незаполненного d-подуровня под воздействием силового поля лиганда. Лиганды, окружая центральный ион, способны возбуждать его, изменяя взаимную ориентацию d-орбиталей. При этом, испытывая влияние лигандов, наиболее сильному возбуждению подвергаются ближайшие к иону dx2-y2 и dz2 орбитали, меньшему – удаленные – dxy, dxz и dyz. В результате ранее единый энергетический подуровень из пяти d-орбиталей центрального иона расщепляется на два разных энергетических подуровня:
 |
Рассмотрим это на примере иона железа Fe2+. Его электронная конфигурация описывается формулой 3d6. В свободном ионе распределение электронов подчиняется правилу Хунда:
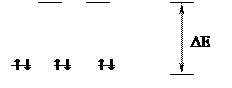
Возникает синглентное состояние центрального атома (отсутствие неспаренных электронов). Выравнивание энергии двух свободных 3d-орбиталей и энергий одной 4s- и трех 4p-орбиталей способствует более легкому их смешиванию (d2sp3-гибридизация) с формированием устойчивого октаэдрического комплекса. Рассмотренный феномен имеет существенное значение, так как обусловливает важнейшую биологическую функцию – транспорт кислорода гемоглобином, в состав которого входит двухвалентное железо.
Для s- и p-элементов эффект расщепления невозможен, что снижает комплексообразующую способность ионов этих металлов.
 2015-07-14
2015-07-14 1129
1129








