В отличие от гомоядерных молекул при построении э нергетических диаграмм гетероядерных двухатомных молекул необходимо учитывать различие энергий атомных орбиталей взаимодействующих атомов. Рассмотрим в качестве примера молекулу HF (Рис. 6). В ней по условиям близости энергий и симметрии (см § 2
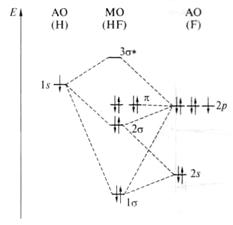
Рис.6. Энергетическая диаграмма МО молекулы HF
этой лекции) могут перекрываться (интерферировать) 1s – АО атома водорода, 2s-, 2р- АО атома фтора. Это приводит к образованию трёх МО σ- типа: 1σ-, 2σ- и 3σ*. Первая из них 1σ- оказывается практически несвязывающей из- за большой разницы энергий 2s- (Е2s = - 40эВ) и 2р – (Е2р = - 17.4эВ) АО атома фтора. Её энергия практически не отличается от энергии 2s- АО атома фтора. 2рх- и 2ру- орбитали атома фтора не имеют подходящих по энергии и симметрии орбиталей атома водорода. Отсутствие перекрывания приводит к тому, что они сохраняют π- симметрию, оказываются несвязывающими и дважды вырожденными. В соответствии с рис. 6 кратность связи H-F равна единице, а основной вклад (90 %) в образование МО вносит атом фтора. Таким образом электронная плотность в молекуле HF смещена к атому фтора, на атоме же водорода возникает положительный заряд, и молекула оказывается полярной.
Вопросы: 1. Почему в молекуле азота 3σ- орбитали расположены по энергии выше, чем 1π-орбитали, а в молекуле фтора?
2.а) Почему потенциал энергии ионизации молекулы азота выше, чем в атоме азота?
2б) Почему у фтора потенциал ионизации молекулы ниже, чем у атома.?
 2015-10-22
2015-10-22 3526
3526