Оксиды – соединение двух элементов, один из которых кислород (К2О, СаО)
Основные оксиды – оксиды, гидраты которых – основания. Все основные оксиды являютя оксидами металлов. Солеобразующие оксиды – оксиды, которые образуют соли при взаимодействии с кислотами или основаниями.
Кислотные оксиды – оксиды, гидраты которых являются кислотами (оксиды неМе, оксиды Ме с высокой валентностью).
Амфотерные оксиды – оксиды, которым соответствуют амфотерные гидроксиды. Все амфотерные оксиды являются основными.
Химические свойства
Основные оксиды:
Взаимодействие
1.С кислотами: Основной оксид + Кислота = Соль + H2O
MgO + 2HCl = MgCl + H2O
2.С кислотными оксидами: Основной оксид + Кислотный оксид = Соль
3Na2O + P2O5 = 2Na3PO4
3.С водой: Оксид + H2O = Щелочь
K2O + H2O = 2KOH
Кислотные оксиды
Взаимодействие
1.С основаниями: Кислотный оксид + Основание = Соль + H2O
CO2 + 2NaOH = Na2CO3 + H2O
2. С основными оксидами: Основной оксид + Кислота = Соль + H2O
CaO + CO2 = CaCO3
3. С водой: Кислотный оксид + H2O = Кислота
SO3 + H2O = H2SO4
Амфотерные оксиды
Взаимодействие
1.С кислотами: Амфотерный оксид + Кислота = Соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2.С щелочами: Амфотерный оксид + Щелочь = Соль + H2O
ZnO + 2KOH = K2ZnO2 + H2O
3.С кислотными оксидами: Амфотерный оксид + Кислотный оксид = Соль
ZnO + CO2 = ZnCO3
4. С основными оксидами: Амфотерный оксид + Основной оксид = Соль
ZnO + Na2O = Na2ZnO2
17. Представление о методе молекулярных орбиталей.
Состояние электронов в атоме описывается как совокупность атомных электронных орбиталей, каждая такая орбиталь характеризуется определенным набором атомных квантовых чисел.
Этот метод иходит из предположения, что состояние электронов в молекуле также может быть описано как совокупность молекулярных электронных орбиталей, причем каждой молекулярной орбитали соответствует определенный набор молекулярных квантовых чисел.
На каждой МО может находиться не более двух элементов с противоположно направленными спинами.
Виды МО
Связывающие. Плотность электронного облака в межъядерном пространстве увеличивается. Электроны находящиеся на связывающей МО наз. связывающими.
Разрыхляющие. Уменьшение абсолютной величины волновой функции. Уменьшается плотность электронного облака. Хим. связь не возникает. Электроны на этой орбитали – связывающие.
Переход электронов с атомных орбиталей на связывающую МО, приводящий к возникновению хим. связи, сопровождается выделением энергии.
Энергия электронов на связывающей орбитали ниже, а на разрыхляющей выше, чем на атомных орбиталях. Наиболее устойчивое состояние молекулы при минимальной энергии.
Уменьшение числа разрыхляющих электронов приводит к повышению кратности связи, и следовательно, к образованию более прочной связи.
Соли. Основные химические свойства.
Соли – это продукты неполного замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксидных групп в молекулах оснований кислотными остатками.
Нормальные соли - то продукты полного замещения атомов водорода в молекуле кислоты атомами неметалла, или продукты полного замещения гидроксидных групп в молекуле основания кислотными остатками.
Кислые соли - это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Основные соли - это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками.
Свойства
Растворимые соли в водных растворах диссоциируют на ионы:
· Средние соли диссоциируют на катионы металлов и анионы кислотных остатков
KCl = K + Cl
· Кислые соли диссоциируют не катионы металла и сложные анионы
KHSO3 = K + HSO3
· Основные металлы диссоциируют на сложные катионы и анионы кислотных остатков
AlOH(CH3COO)2 = AlOH + 2CH3COO
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Ме(1) + Соль(1) = Ме(2) + Соль(2)
CuSO4 + Fe = FeSO4 + Cu
3. Растворы взаимодействуют с щелочами Раствор соли + Раствор щелочи = Новая соль + Новое основание
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
4. Соли взаимодействуют с кислотами Соль + Кислота = Соль + Кислота
BaCl2 + H2SO4 = BaSO4 + 2HCl
5. Соли могут взаимодействовать между собой Соль(1) + Соль(2) = Соль(3) + Соль(4)
AgNO3 + KCl = AgCl + KNO3
6. Основные соли взаимодействуют с кислотами Основная соль + Кислота = Средняя соль + H2O
CuOHCl + HCl = CuCl2 + H2O
7. Кислые соли взаимодействуют с щелочами Кислая соль + Щелочь = Средняя соль + H2O
NaHSO3 + NaOH = Na2SO3 + H2O
8. Многие соли разлагаются при нагревании
MgCO3 = MgO + CO2
30. Изотерма химической реакции. Стандартное изменение свободной энергии.
Рассмотрим гомогенную газовую реакцию А + 2В = 3D в состоянии, далёком от равновесия. Исходные парциальные давления участников реакции PA0,PB0,PD0. Если ΔG<0, то равновесие смещено направо, если ΔG>0, то влево.
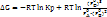 - это уравнение изотермы химической реакции (изотрема Ванн-Гоффа), оно позволяет определить, в каком направлении будет протекать реакция для данного состава реакционной системы.
- это уравнение изотермы химической реакции (изотрема Ванн-Гоффа), оно позволяет определить, в каком направлении будет протекать реакция для данного состава реакционной системы.
Если 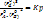 , то ΔG=0 и в системе равновесие.
, то ΔG=0 и в системе равновесие.
При больших PA0 и PB0 и малом PD0 ΔG<0 (оба слагаемых изотермы образуют продукт реакции D).
Если исходные вещества и полученные продукты находятся в стандартном расстоянии, получим уравнение для случая стандартного изменения свободной энергии: ΔG0 = - RTLnKp.
Для элементов в стандартном состоянии 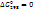
 2018-01-21
2018-01-21 1640
1640
