2.1 Определение ПР по значению рНо
Изображают зависимости рН от объема прилитого титранта.
По кривой титрования определяют:
– объем раствора гидроксида натрия, пошедший на титрование кислоты;
– объем раствора гидроксида натрия, пошедший на осаждение ионов металла;
– рН начала образования гидроксида металла (II).
Рассчитывают в растворе, в момент начала образования осадка:
1) молярную концентрацию всех ионов;
2) ионную силу (I), по формуле (150);
3) коэффициент активности g ионов М2+, исходя из формулы:
 . (178)
. (178)
где z – заряд иона;
I – ионная сила, моль/дм3.
Коэффициент уравнения (178) описывает зависимость коэффициента активности от свойств растворителя и температуры:
 (179)
(179)
где NA = 6.022×1023 моль-1 – постоянная Авогадро;
e о = 8.854×10-12 Ф/м (Ф º м-2×кг-1×с4×А2) – диэлектрическая проницаемость вакуума;
e – диэлектрическая проницаемость воды;
k = 1.381×10-23 Дж/К (м2×кг×с-2×K-1);
Т – температура, К.
Подставив все постоянные значения физических величин в уравнение (179), получаем:
 (дм3/моль)1/2 . (180)
(дм3/моль)1/2 . (180)
При Т = 25 °С А = 0.509 (дм3/моль)1/2;
4) активность металла (II) по формуле:
 , моль/дм3, (181)
, моль/дм3, (181)
g – коэффициент активности ионов металла (II),
с (M2+) – молярная концентрация ионов металла (II), моль/дм3;
5) значение рНо , исходя из формулы (176);
6) ПР, исходя из формулы (177);
7) среднее значение двух измерений ПР и его стандартное отклонение.
Таблица 15.2 – Значения ПР малорастворимых гидроксидов двухвалентных металлов, рассчитанные по значениям рНо
| Номер опыта | Молярная концентрация ионов, с (Х), моль/дм3 | Ионная сила
I, 
| Kоэф-фи-циент активности g | Активность металла (II)
а (М+2),

| рН | рНо |
ПР,

| ||
| М+2 | SO42- | 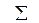 Na+, Cl-,
NO3-
Na+, Cl-,
NO3-
| |||||||
ЛИТЕРАТУРА
| Байрамов В.М. Основы химической кинетики и катализа / под ред. В. В. Лунина. – М.: ИЦ Академия, 2003. – 256 с. | |
| Байрамов В.М. Химическая кинетика и катализ. Примеры и задачи с решениями. – М.: ИЦ Академия, 2003. – 320 с. | |
| Романовский Б. В. Основы химической кинетики. – М.: Экзамен, 2006. – 415 с. | |
| Основы физической химии. Теория и задачи / В. В. Еремин, С. И. Карпов, И. А. Успенская, Н. Е. Кузменко, В. В. Лунин. – М.: Экзамен, 2005. – 480 с. | |
| Практическая химическая кинетика / под ред. М. Я. Мельникова. – М.: Изд-во МГУ; СПб: Изд-во СПбГУ, 2006. – 592 с. | |
| Практикум по физической химии / под общ. ред. Н. К. Воробьева. – Изд. 4-е, перераб. и доп. – М.: Химия, 1975. – 368 с. | |
| Практические работы по физической химии / под ред. К. П. Мищенко, А. А. Равделя, А. М. Пономаревой. – Изд.4-е, перераб. и доп. – Л.: Химия, 1982. – 400 с. | |
| Практикум по физической химии / под ред. С. В. Горбачева. – Изд. 3-е, перераб. и доп. – М.: Высшая школа, 1974. – 496 с. | |
| Краткий справочник физико-химических величин / под ред. А. А. Равделя и А. М. Пономаревой. – Изд. 8-е, перераб. –Л.: Химия, 1983. –232 с. |
ПРИЛОЖЕНИЕ
Таблица 1 – Коэффициенты распределений (Р = 0.95)
| Число измерений | Коэффициенты распределения Стьюдента | Критические значения коэффициента корреляции | Число измерений | Коэффициенты распределения Стьюдента | Критические значения коэффициента корреляции |
| N | t | r | N | t | r |
| 12.7 4.30 3.18 2.78 2.57 2.45 2.37 2.31 2.26 2.23 2.20 2.18 2.16 2.15 2.13 | 0.9969 0.9500 0.8783 0.8114 0.7545 0.7067 0.6664 0.6319 0.6021 0.5760 0.5529 0.5324 0.5139 0.4973 | 2.12 2.11 2.10 2.09 2.09 2.08 2.07 2.07 2.06 2.06 2.05 2.04 2.03 2.03 2.02 | 0.4821 0.4583 0.4555 0.4438 0.4329 0.4227 0.4132 0.4044 0.3961 0.3882 0.3729 0.3610 0.3388 0.3291 0.2973 |
Таблица 2 – Физические свойства воды
| Температура | Т °С | ||||||
| Плотность | r, г/см3 | 0.9991 | 0.9990 | 0.9988 | 0.9986 | 0.9984 | 0.9982 |
| Диэлектрическая проницаемость | e | 81.97 | 81.59 | 81.21 | 80.84 | 80.46 | 80.08 |
| Вязкость | h ×103,, Па×с | 1.138 | 1.111 | 1.084 | 1.057 | 1.029 | 1.002 |
| Температура | Т °С | ||||||
| Плотность | r, г/см3 | 0.9980 | 0.9978 | 0.9976 | 0.9973 | 0.9971 | 0.9968 |
| Диэлектрическая проницаемость | e | 79.71 | 79.35 | 78.98 | 78.62 | 78.25 | 77.89 |
| Вязкость | h ×103, Па×с | 0.980 | 0.957 | 0.935 | 0.913 | 0.890 | 0.874 |
Таблица 3 – Свойства органических соединений
| Соединение | Брутто формула | Температура Т °С | Плотность r, г/см3 | Показатель преломления n |
| Ацетон | С3Н6О | 0.7920 | 1.3591 | |
| Метиловый эфир уксусной кислоты | С3Н6О2 | 0.9338 | 1.3593 | |
| Пропанол | С3Н8О | 0.8044 | 1.3854 | |
| Изопропанол | С3Н8О | 0.7855 | 1.3776 | |
| Глицерин | С3Н8О3 | 1.260 | 1.4729 | |
| Винилацетат | С4Н6О2 | 0.9320 | 1.3958 | |
| Бутен-1 | С4Н8 | 0.6680 | 1.3792 | |
| Бутанол-1 | С4Н10О | 0.8098 | 1.3993 | |
| Бутанол-2 | С4Н10О | 0.8080 | 1.3954 | |
| Изобутиловый спирт | С4Н10О | 17.5 | 0.8050 | 1.3968 |
| Третичный бутиловый спирт | С4Н10О | 0.7800 | 1.3878 | |
| Масляная кислота | С4Н8О2 | 0.9587 | 1.3990 | |
| 1,4-диоксан | С4Н8О2 | 1.0338 | 1.4224 | |
| Этиловый эфир уксусной кислоты | С4Н8О2 | 19.2 | 0.9010 | 1.3728 |
| Амиловый спирт | С5Н12О | 0.8144 | 1.4099 | |
| Изоамиловый спирт | С5Н12О | 0.8120 | 1.4058 | |
| Ацетилацетон | С5Н8О2 | 25(17) | 0.9720 | 1.4541 |
| Бензол | С6Н6 | 0.879 | 1.5017 | |
| Гексен -1 | С6Н12 | 0.6732 | 1.3821 | |
| н -Гексан | С6Н14 | 0.6594 | 1.3754 | |
| Гексанол-1 | С6Н14О | 20 (25) | 0.8186 | 1.4158 |
| Ацетоуксусный эфир | С6Н10О3 | 20 (18) | 1.0280 | 1.4209 |
| Гептан | С7Н16 | 0.6840 | 1.3876 | |
| Гептанол | С7Н16О | 0.8240 | 1.4215 | |
| Толуол | С7Н8 | 0.8669 | 1.4969 | |
| Гептен-1 | С7Н14 | 0.6970 | 1.3998 | |
| Изоамилацетат | С7Н14О2 | 0.8719 | 1.4054 | |
| о -Ксилол | С8Н10 | 0.8968 | 1.5055 | |
| m -Ксилол | С8Н10 | 0.8642 | 1.4972 | |
| Октен-1 | С8Н10 | 0.7155 | 1.4088 | |
| Декан | С10Н22 | 0.7300 | 1.4120 | |
| Пентадекан | С15Н32 | 0.7685 | 1.4315 |
Учебное пособие
 2015-10-22
2015-10-22 544
544








