Атомы имеют сложное строение. Большой вклад в представление о современной модели атома внесли такие ученые как Дж. Резерфорд, Томпсон, Нильс Бор, де-Бройль и др.
Современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках. Современная модель атома предполагает:
- в центре атома находится положительно заряженное ядро очень малых размеров, в котором сосредоточена почти вся масса атома;
- вокруг ядра послойно вращаются электроны, их число равно заряду ядра;
- электрон может вращаться вокруг ядра не по любым, а только по строго определенным орбитам, причем электрон не излучает электромагнитной энергии, излучение происходит при скачкообразном переходе электрона с одной орбиты на другую.
С этой точки зрения наиболее важным является то, что вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: n – главное квантовое число, l – орбитальное квантовое число, me – магнитное квантовое число, ms – спиновое квантовое число.
Волновая функция электрона зависит от трех квантовых чисел n, l, и m. Индекс n волновой функции электрона в атоме называется главным квантовым числом, характеризующим энергетический уровень электрона. Оно может принимать целочисленные значения от 1, 2, 3,...до ∞. Если n = ∞, то это значит, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома). Число энергетических уровней в атоме равно номеру периода в таблице Д.И. Менделеева, в котором находится элемент.
Орбитальное квантовое число l отражает симметрию пространства, в котором движется электрон. Квантовое число l является мерой орбитального механического момента электрона. Абсолютная величина этого момента зависит от n и может принимать значения: l = n-1.
Волновую функцию электрона в атоме называют атомной орбиталью. В соответствии со значением орбитального квантового числа 1 приняты следующие обозначения атомных орбиталей:
1 = 0 1 2 3 – орбитальное квантовое число;
s p d f – обозначение орбитали.
Для уровня с главным квантовым числом n = 1 возможна 1s-орбиталь, для n = 2 возможны 2s- и 2p-орбитали, для n=3 возможны 3s-, 3p- и 3d-орбитали, для n=4 – (4s-, 4p-, 4d- и 4f) орбитали.
Магнитное квантовое число mе характеризует пространственное расположение орбиталей относительно некоторого фиксированного направления. Магнитное квантовое число зависит от орбитального квантового числа и принимает значения от (– l до + l).
Соотношения между значениями 1 и mе для различных подуровней следующие:
| n | ||||
| S | p | D | F | |
| l | ||||
| mе | -1, 0, +1 | -2, -1, 0, +1, +2 | -3, -2, -1, 0, +1, +2, +3 |
Следовательно, s-орбиталь не ориентирована в пространстве и ее граничной поверхностью является сфера, р-орбитали ориентированы в трех направлениях (px, py, pz) и каждая имеет вид замкнутой гантелеобразной поверхности. d- и f-орбитали имеют более сложную форму.
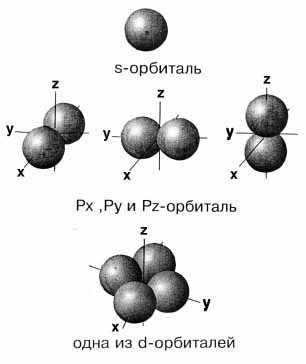
Рис. 2.1. Модели атомных орбиталей
Кроме орбитального механического момента 1, электрон обладает собственным или врожденным механическим моментом S. Этот момент называется спином (В. Паули, 1924г.) Спин электрона возникает за счет вращения его вокруг собственной оси. По аналогии с орбитальным квантовым числом 1 вводится спиновое квантовое число ms. Спиновое магнитное число может принимать только два значения: + ½ и – ½. Состояния электрона с ms = ½ часто называют «спин вверх», и с ms = - ½ - «спин вниз». Обычно эти состояния электрона условно обозначают стрелкой, направленной вверх или вниз ↑ ↓.
Таким образом, состояние электрона в атоме можно описать с помощью четырех квантовых чисел: n, l, me и ms.
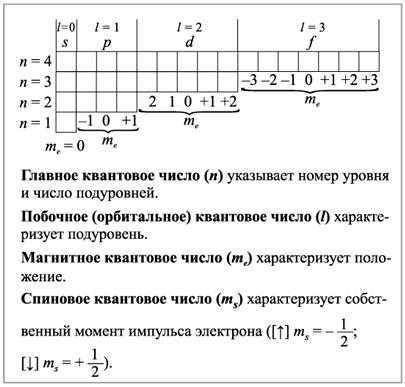
Рис.2.2.Значение квантовых чисел элементов по периодам
 2015-10-22
2015-10-22 2007
2007
