В 1913 г. датский физик Нильс Бор (1885—1962) для объяснения стабильности атомов сформулировал два постулата, содержание которых находилось в явном противоречии с классической физикой.
Первый постулат Бора гласит о том, что существуют такие стационарные орбиты для электрона в атоме, находясь на которых электрон не излучает.
Для стационарных круговых орбит должно выполняться условие: длина окружности орбиты равна целому числу волн де Бройля электрона, движущегося по орбите, т. е. 2кгп = nh/mvn.
Второй постулат Бора утверждает, что излучение наблюдается только при переходе атома из одного стационарного состояния с энергией Еп в другое с энергией Ет9 причем в результате такого перехода энергия кванта излучения равна
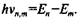
Математическое выражение второго постулата называется формулой Бора.
Постулаты Бора позволяют получить для частот линий излучения в спектре водорода выражение, совпадающее с формулой Баль-мера. Действительно, полная энергия Е„ электрона на круговой орбите с радиусом гп равна сумме кинетической энергии электрона mv2/2 и потенциальной энергии, определяемой энергией электростатического взаимодействия отрицательно заряженного электрона с положительно заряженным ядром 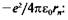
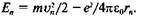
В соответствии со вторым законом Ньютона произведение массы электрона на его центростремительное ускорение равно кулоновской силе, действующей на электрон: 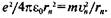 Следователь-
Следователь-
но, полная энергия электрона в атоме равна:
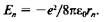
Воспользуемся первым постулатом Бора для определения условия квантования для скорости и радиуса орбиты электрона в атоме:
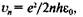
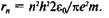
Орбита электрона в атоме при п = \ называется первой боровской орбитой. Из полученного выражения видно, что радиус первой боровской орбиты выражается через фундаментальные константы: гх = = /г22г0/ке2т.
Подставляя полученное выражение для гп в формулу для полной энергии электрона в атоме, получим
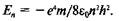
Из формулы Бора определим энергию кванта излучения, покидающего атом при переходе электрона из т-то энергетического состояния в я-е состояние:
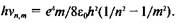
Полученная формула полностью совпадает с формулой Бальме-ра при условии, что 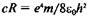 и п = 2. Отсюда постоянную Рид-
и п = 2. Отсюда постоянную Рид-
берга можно выразить через Е,1)(г),эВ фундаментальные физические константы. Расчет значения постоянной Ридберга оказывается в полном согласии с экспериментом. Другим значениям п соответствуют линии излучения атома водорода, наблюдаемые в ультрафиолетовом и инфракрасном участках спектра.
На рисунке 118 изображена диаграмма, иллюстрирующая зависимость энергии атома в различных состояниях от числа п, характеризующего состояние электрона в атоме водорода. Цветная линия выражает зависимость потенциальной энергии взаимодействия электрона с ядром атома водорода.
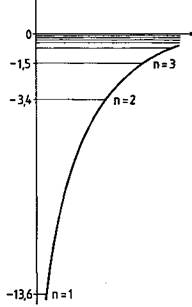 |
| Энергия атома водорода в различных стационарных состояниях |
Таким образом, теория Бора исходя из очевидного факта стабильности атомов и применимости закона сохранения энергии для описания внутриатомных процессов приводит к впечатляющим результатам. Получено явное выражение для энергии атома в п-ы энергетическом состоянии, с помощью которого можно определить характер спектра излучения атома водорода, причем если приравнять п единице, а т бесконечности, то можно получить значение энергии ионизации, т. е. той энергии, которую нужно сообщить электрону, чтобы оторвать его от атома. Для атома водорода энергия ионизации равна по расчетам 13,6 эВ, что полностью соответствует эксперименту.
Постоянную Ридберга удалось выразить с помощью фундаментальных констант, радиус орбиты электрона в атоме водорода оказывается кратным первому боровскому радиусу, причем кратность определяется квадратом целого числа п.
Несмотря на очевидные успехи теории Бора при объяснении строения атома водорода и характерные особенности его спектров, ее не удалось распространить на другие, более сложные квантовые объекты. Постулаты Бора следует рассматривать как эвристические
 2015-07-21
2015-07-21 1509
1509