Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар. Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: неполярную и полярную
 Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента (электронное облако распределяется в пространстве симметрично относительно ядер атомов). Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками).
Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента (электронное облако распределяется в пространстве симметрично относительно ядер атомов). Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками).
 Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной. Схематично образование ковалентной полярной связи в молекуле НСl можно изобразить так:
Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной. Схематично образование ковалентной полярной связи в молекуле НСl можно изобразить так:
Предельным случаем ковалентной полярной связи является ионная связь. Она образуется атомами, электроотрицательности которых значительно различаются. При образовании ионной связи происходит почти полный переход связующей электронной пары к одному из атомов, и образуются положительный и отрицательный ионы, удерживаемые вблизи друг друга электростатическими силами. Поскольку электростатическое притяжение к данному иону действует на любые ионы противоположного знака независимо от направления, ионная связь, в отличие от ковалентной, характеризуется ненаправленностью и ненасыщаемостью. Молекулы с наиболее выраженной ионной связью образуются из атомов типичных металлов и типичных неметаллов (NaCl, CsF и т.п.), т.е. когда различие в электроотрицательности атомов велико. Ионная связь не обладает направленностью, т.к. электрическое поле обладает сферической симметрией и убывает по одному закону в любом направлении. Она не обладает насыщенностью. Поэтому к данному иону может присоединится различное число ионов. Это обуславливает склонность ионных молекул к ассоциации, т.е. к их соединению друг с другом.
3.5. Механизмы образования ковалентной связи (обменный и донорно-акцепторный). Примеры. Молекулы HCl NH3 BF3 NH4+ BF4-
ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
BF3 – B выделяет три атомные орбитали, на каждой их которых есть по одному электрону
3F перекрывают своими атомными обриталями элеткроны, тем самым создавая три пары элеткронов
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора.
Пример – [BF4]-
 BF3 имеет свободную p-орбиталь. F имеет электронную пару. В образовавшемся ионе BF4 все четыре ковалентные связи бор-фтор равноценные по длине и энергии, несмотря на различия в механизме их образования.
BF3 имеет свободную p-орбиталь. F имеет электронную пару. В образовавшемся ионе BF4 все четыре ковалентные связи бор-фтор равноценные по длине и энергии, несмотря на различия в механизме их образования.
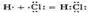 Схематично образование ковалентной полярной связи в молекуле НСl можно изобразить так: Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд
Схематично образование ковалентной полярной связи в молекуле НСl можно изобразить так: Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд  , а на атоме водорода — частичный положительный
, а на атоме водорода — частичный положительный 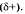 . Таким образом, молекула становится полярной:
. Таким образом, молекула становится полярной: 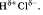
Классы неорганических соединений.
Вещества делятся на простые и сложные. Простые делятся на металлы и неметаллы.
Металлы: металлический блеск, ковкость, тягучесть, хорошая теплопроводность, электрическая проводимость, твердые. Неметаллы хрупки, плохо проводят тепло и электричество. Сложные вещества делятся на органические и неорганические.
Неорганические делятся по составу: Бинарные соединения: оксиды (O), галогениды (галогены), нитриды(N), карбиды(C), гидриды(H) или по функциональным признакам:
Оксиды: несолеобразующие(N2O, NO) и солеобразующие(основные, кислотные, амфотерные)
Основные + кислота (кислотные оксиды)=соль основные + воды =основание
Кислотные + основания (основные оксиды)=соль кислотные + вода =кислота
Амфотерные: и с кислотами и с основаниями.
Гидроксиды: OH (так же основные(NaOH Ba(OH)2) кислотные(HNO3 H3PO4) и амфотерные (Zn(OH)2 Al(OH)3))
Основания: вещ. диссоциирующие на гидроксид-ион. Основные гидроксиды.
Кислоты: вещ. диссоциирующие на ионы водорода. Кислотные гидроксиды.
Соли: вещ. диссоциирующие на полож. ионы не водород и отр ионы не гидроксогрупп.
 2015-10-22
2015-10-22 4339
4339
