В ряде случаев сварки состав металла шва, для обеспечения его качества и эксплуатационных свойств, должен отличаться от сотава свариваемого металла, в частности по содержанию различных легирующих элементов. В связи с этим, процессом, сопутсвующим ряду других видов металлургической обработки металла при сварке часто является легирование металла шва.
Легирование металла при сварке возможно посредством воздействия металлической ли шлаковой фаз, а также газов.
Основным способом легирования металла шва при сварке является легирование посредством введения в сварочную ванну соответствующих элементов в металлическом состоянии, в частности в виде сплавов. Легирование в этом случае происходить в результате:
а) поступление легирующего элемента из расплавляющегося при сварке основного свариваемого металла;
б) поступление легирующего элемента из присадочного металла (плавящихся электродной проволоки, электродного стержня при дуговой и электрошлаковой сварке);
в) введение легирующего элемента в состав покрытия при сварке штучными электродами или керамического флюса при автоматической сварке под флюсом.
При рассмотрении легирования металла шва пользуются суммарным коэффициентом усвоения легирующего элемента.
 ,
,
где Кусв.Ме − суммарный коэффициент усвоения элемента Ме;
[Ме]ш − количество элемента Ме в металле сварного шва;
[Me]о.м.; [Ме]э.п.; [Ме]g − количество этого элемента соответственно в основном металле, электродной проволоке (стержне) и металлической добавке в керамический флюс или покрытие;
1−γ−с − доли участия в образовании металла сварного шва соответственно основного металла, электродной проволоки и металлической добавки во флюс (покрытии).
Это справедливо для процессов сварки, когда легирование металлической фазы может происходить в результате поступления легирующих элементов из всех трех источников (сварке под керамическим флюсом).
При автоматической сварке под флюсом количество расплавленного флюса (а следовательно и легирующей добавки) зависит от режима сварки и является величиной переменной.
 , где
, где
 ;
;  ;
; 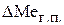 − количество элемента Ме, перешедшего в расплавленный металл, окислившегося и попавшего в шлак и удалившегося в газовую среду (сюда входят потери на разбрызгивание).
− количество элемента Ме, перешедшего в расплавленный металл, окислившегося и попавшего в шлак и удалившегося в газовую среду (сюда входят потери на разбрызгивание).
Суммарное долевое участие все составляющих металла шва (основного металла, электродной проволоки и металлической добавки из флюса) равно 1.
Доля основного металла в шве (γ) в зависимости от режима сварки, свойств основного металла и электродной проволоки составляет обычно γ=(0,5 − 0,8).
Доля металлической добавки флюса в составе шва (С) определяется в основном количеством металлической добавки во флюсе (зависит также от свойств флюса режима сварки). Ее величина может быть определена формулой 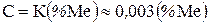 , где (%Ме) − содержание металлической добавки в составе флюса, %.
, где (%Ме) − содержание металлической добавки в составе флюса, %.
Т.к. количество металлической добавки во флюсе не превышает 20−25%, величина «С» обычно меньше (0,08). С=(0,06…0,075).
Обычно для расчета состава наплавленного металла пользуются коэффициентами перехода.
1)  ,
,
где  − количество элемента Ме, перешедшего в наплавленный металл; г.
− количество элемента Ме, перешедшего в наплавленный металл; г.
 − количество легирующего элемента в электроде (проволоке).
− количество легирующего элемента в электроде (проволоке).
Лучше использовать относительные количества, т.е. концентрации рассматриваемого элемента в электроде с отнесением этой величины к металлической части электрода.
2)  ,
,
где 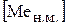 − относительная концентрация рассматриваемого элемента в наплавленном металле;
− относительная концентрация рассматриваемого элемента в наплавленном металле;
 − концентрация элемента в электроде.
− концентрация элемента в электроде.
Пример. Металлическая часть электрода состоит из 80% Fe, 18% Ni, 2% Al. Пусть расплавляется 100г электрода (80г Fe,18г Ni, 2г Al).
В процессе сварки элементы будут окисляться. Будем считать, что в наплавленном металле будет Feн.м.=70г; Niн.м.=16,5г; Alн.м.=0,5г (всего 87г). Это отвечает составу наплавленного металла:

Расчет коэффициента перехода  по формуле (а) и
по формуле (а) и  по формуле (б) дает следующие значения:
по формуле (б) дает следующие значения:
1)  ;
;  ;
; 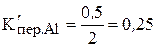 .
.
2) 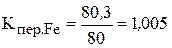 ;
;  ;
;  .
.
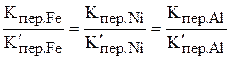 .
.
Проще пользоваться Кпер.Ме
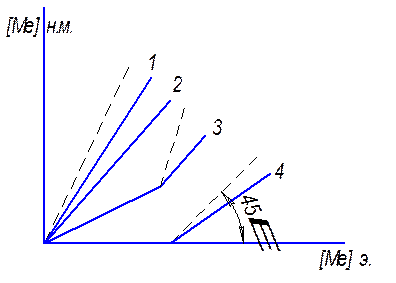
Схема связи между концентрациями элемента в электроде и в наплавленном металле изображена на рис. а).
Кривая 1 − элемент, близкий к основе сплава, не обладающий большим сродством к О2 и неимеющий повышенных потерь испарением. К−т перехода таких элементов близок к единице. Кривая 4 − элемент, обладающий большим сродством к О2, чем основа сплава, выступающий как раскислитель; элемент, потери которого определяются в основном повышенным избирательным испарением или относительно небольшой окисляемостью по сравнению с основой сплава, или защищенный от окисления достаточным количеством более сильных раскислителей, по коэффициенту перехода будут характеризоваться кривой 2. Кривая 3 характеризует переход элемента с менее сильной раскисляющей способностью, чем у элемента, характеризуемого кривой 4, но обладающего большим сродством к кислороду, чем у элемента, характеризуемого кривой 2.
Коэффициенты перехода из электродной проволоки и электродного покрытия неодинаковы. Коэффициент перехода элемента из покрытия несколько меньше, чем из стержня, в связи с более сильным, воздействием окислителей, выделяемых покрытием и возможным неполным растворением элемента из покрытия в металле.
Тогда содержание элемента в наплавленном металле будет определяться формулой
 где Кпер.Меэ.с. и Кпер.Меэ.п. − коэффициент перехода Ме из электродного стержня и электродного покрытия;
где Кпер.Меэ.с. и Кпер.Меэ.п. − коэффициент перехода Ме из электродного стержня и электродного покрытия;
 − относительная масса покрытия;
− относительная масса покрытия;
РМе − относительное количество в составе покрытия материала, содержащего элемент Ме в металлическом состоянии;
[Ме]н.м.; [Ме]э.с.; [Ме]Рме − концентрации элемента Ме соответственно в наплавленном металле, электродном стержне и материлае Р покрытия.
В ряде случаев различием значения коэффициента перехода элемента из электродного стержня и электродного покрытия можно пренебречь и пользоваться одним значением коэффициента перехода. Тогда формула упрощается:
 .
.
Коэффициенты перехода элементов, особенно обладающих значительным сродством к кислороду, зависят от количества электродного покрытия.
а) окисляющее воздействие кислорода воздуха и покрытия при различной его толщине;
б) влияние толщины покрытия на коэффициент перехода элемента из покрытия в наплавленный металл;
в) кривая 1 − окислительное действие воздуха, кривая 2 − окислительное действие самого покрытия (по мере увеличения δ количество покрытия увеличивается быстрее). Кривая 3 − суммарное действие.
Коэффициенты перехода различных элементов зависят как от типа покрытия, так и от степени связывания кислорода О2 покрытия введенными в него раскислителями.
Например Кпер.Cr = 0,45−0,65 (в зависимости от типа покрытия).
Значение коэффициентов перехода легированных элементов сталей при сварке электродами с флюоритово−известковым покрытием.
| Элемент | Ni | Cr | Mo | Mn | V | C |
| Коэффиц. перехода | 0,91−1,0 | 0,85−0,92 | 0,8−0,85 | 0,55−0,7 | 0,8−0,85 | 0,46−0,6 |
Легирование металла посредством шлаковой фазы
Легирование наплавленного металла в результате обменных реакций используют обычно при необходимости введения небольших количеств легирующих элементов.
 , в которых
, в которых  выступает как легирующий элемент.
выступает как легирующий элемент.
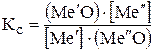 ;
;  (основа сплава).
(основа сплава).
 ;
;  .
.
 ,
,
 .
.
Концентрация легирующего элемента  тем больше, чем больше свободного оксида этого элемента в шлаке и чем меньше окислен металл растворимым оксидом основного сплава. (Применение − при автоматической сварке под плавлеными флюсами).
тем больше, чем больше свободного оксида этого элемента в шлаке и чем меньше окислен металл растворимым оксидом основного сплава. (Применение − при автоматической сварке под плавлеными флюсами).
Легирование воздействием газовой фазы на металл имеет при сварке второстепенные значения. (При газовой сварке при избытке ацетилена содержание углерода повышается до 1%; при дуговой сварке плавящимся электродом в СО2 тоже некоторое науглероживание наплавленного металла всего до 0,05% по сравнению с содержанием в проволоке), электродные покрытия, содержащие значительные количества углекислых солей (мрамора), также могут науглероживать наплавленный металл.
Степень такого нуглероживания возрастает при увеличении в металле концентрации сильных раскислителей, например
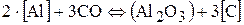 (концентрация С может быть повышена на 0,1−0,2%).
(концентрация С может быть повышена на 0,1−0,2%).
Науглероживание металла при сварке возможно высоколегированными стальными электродами содержащими хром в больших концентрациях (до 0,01−0,03%).
В целом процессы науглероживания при сварке являются отрицательными, легирование по этой схеме используется только при наплавке.
В зависимости от состава шлаковой фазы компоненты (S, P) могут извлекаться из металла путем связывания их в шлаке в устойчивые соединения или, наоборот, можно легировать металл через шлак нужными компонентами (Mn, Si), создавая условия для благоприятного протекания реакций на границе металл−шлак.
Иногда для сварки используют шлаки такого состава, которые практически не реагируют с металлом сварочной ванны, а осуществляют только защиту от воздушной атмосферы. Большая скорость сварочных процессов в этом случае ограничивает диффузию газов через шлаковую фазу по времени.
По составу и назначению, а также и по физическим свойствам шлаки можно разделить на отдельные виды и группы.
1. По отношению к окислению металла: восстановительные и окислительные шлаки.
Восстановительные шлаки содержат малое количество окислов основного металла или совсем их не содержат. В этом случае окислы, растворенные в металле, переходят в шлак, и происходит процесс диффузионного раскисления.
Шлак (FeO)
Металл [FeO]
 .
.
(Содержание FeO и S во флюсах должно быть минимальным, чтобы они могли извлекаться из металла в шлак).
Окислительные шлаки содержат большое количество окислов основного металла и окисляют его:
Шлак (FeO)
Металл [FeO]
(Окислительные флюсы применяются при выплавке стали в мартеновых печах для понижения содержания в стали углерода Mn, Si, P).
Шлаки представляют собой сложную систему из окислов или нейтральных солей, между которыми могут происходить химические реакции, приводящие к образованию новых веществ.
Шлаковые компоненты, применяемые в сварочной металлургии, можно разделить на 4 группы веществ: кислотные, амфотерные, основные окислы и нейтральные соли.
| Кислотные | Амфотерные | Основные окислы | Нейтральные соли |
| SiO2; TiO2; В2О3; Р2О5; (Na2B4O7) | Al2O3; Cr2O3; (Fe2O3) | Na2O; К2О; СаО; MgO; FeO; MnO | CaF2; Na3AlF6; KF; NaF; BaF2; KCl; NaCl; BaCl2; MgCl2 |
1) SiO2 описано выше.
2) TiO2 − активность ниже, чем у SiO2
СаО+TiO2→CaTiO3 − титанат кальция
BaO+TiO2→BaTiO3 − титанат бария
TiO2 может переходить в низкие окислы (Ti2O3; Ti3O5; TiO).
3) B2O3 − борный ангидрид (Тпл=577оС).
С основными окислами бор дает соли:
Na2O+B2O3→2NaBO2 − метаборат;
3Na2O+B2O3→2Na3BO3 − ортоборат;
Na2O+2B2O3→Na2B4O7 − тетраборат (бура). (Тпл.=878оС).
B2O3 − кислотный окисел, употребляющийся во флюсах для пайки и сварки цветных металлов.
4) Fe2O3 − сильными окислительными свойствами обладает, не должен содержаться в сварочных шлаках.
5) Al2O3 в расплавленном состоянии проводит электрический ток, диссоциируя на ионы:
 ;
;  .
.
С основными окислами Al2O3 дает соли:
 − метаалюминат кальция;
− метаалюминат кальция;
 − ортоалюминат кальция.
− ортоалюминат кальция.
С кислотными окислами алюминий будучи амфотерным дает солеобразные соединения:
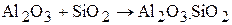 силлиманит;
силлиманит;
 муллит.
муллит.
Присоединяя дополнительно окислы металлов, они образуют новый класс соединения − алюмосиликаты.
Такими алюмосиликатами являются полевые шпаты, которые применяются для изготовления электродных покрытий и флюсов:
 − ортоклаз;
− ортоклаз; 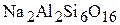 −альбит;
−альбит;  − аннорит.
− аннорит.
6). CaO и MgO − основные окислы.  = 2560о С,
= 2560о С,
 = 2800о С.
= 2800о С.
СаО, обладая основными свойствами значительно активнее, чем FeO и MnO, и поэтому легко вытесняют их из солей, выделяя большое количество энергии:
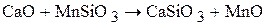 ; ΔНо = −72,7 кДж.
; ΔНо = −72,7 кДж.
 ; ΔНо = 95,3 кДж.
; ΔНо = 95,3 кДж.
7). Нейтральные соли, являющиеся устойчивыми химическими соединениями в малой степени реагирующими с металлом, на поверхности которого они находятся. Расплавы этих солей являются хорошими электролитами.
Физико-химические свойства сварочных шлаков
Требования к сварочным шлакам:
1). Обеспечить получение металла сварочной ванны или металла сварного шва определенного состава и определенных свойств;
2). Обеспечение технологического процесса сварки − устойчивого дугового разряда, хорошее формирование шва и легкая отделяемость шлаковой корки от готового изделия.
Физико-химические свойства
Физические свойства характеризуются:
1). Тепловыми константами − температурой плавления или размягчения, теплоемкостью, скрытой теплотой плавления и теплосодержанием шлака;
2). Вязкостью в жидком состоянии и ее изменением с температурой;
3). Газопроницаемостью;
4). Плотностью в жидком состоянии;
5). Свойствами, определяющими отделимость шлака от металла шва в твердом состоянии.

Большинство сварочных шлаков характеризуются большой склонностью к переохлаждению, что повышается их повышенной вязкостью в жидком состоянии.
Точное определение температуры плавления шлаков затруднительно, т.к. соответствующие критические точки превращений выражены неотчетливо, а иногда и вовсе отсутствуют.
Для шлаков характерно наличие некоторого интервала плавления, лежащего между температурами начала размягчения шлака и его перехода в жидкое состояние, отвечающее полному плавлению. Интервал плавления у кислых шлаков обычно больше, чем у основных. Температура плавления сварочного шлака должна быть ниже температуры плавления свариваемого металла (снижает температуру плавления CaF2).
От температуры размягчения и плавления шлаков следует отличать температуру образовавшихся шлаков при плавлении электродных покрытий или керамических флюсов, представляющих собой механическую смесь измельченных компонентов, связанных обычно раствором жидкого стекла. Для такого шлака характерна температура плавления смеси окислов, его составляющих. Обычно она несколько выше, чем для сплавленного шлака того же состава, но также как и для сплавленного шлака − должна быть ниж температуры плавления металла.
Вязкость.
Активность жидких шлаков при взаимодействии с металлом в значительной мере зависит от их вязкости и характера ее изменения с ростом температуры. На рис. 1 приведены кривые вязкости сварочных шлаков.
Кривая 1, соответствующая «коротким» шлакам, показывает, вязкость их почти постоянна в пределах 1100 − 1400о С и составляет доли пауза. При Т ≈ 1100о С вязкость «короткого» шлака резко повышается, и он затвердевает. Таким образом «короткий» шлак быстро затвердевает с поверхности, оставаясь в то же время в жидком состоянии в зоне соприкосновения с кристаллизирующимся металлом; это обеспечивает как свободный выход газов из металла, так и соответствующее формирование шва. «Короткие» шлаки являются основными.
Кривая 2 отвечает «длинным», более густым шлакам, вязкость которых медленно снижается в интервале температур 1100 − 1400о С. Такие шлаки постепенно переходят сначала из жидкого состояния в тестообразное, а затем − в твердое состояние, и поэтому трудно установить температуру их затвердевания. Переход из тестообразного состояния в твердое у «длинных» шлаков сопровождается нарастанием вязкости шлака, при котором затрудняется соответствующая перегруппировка частиц, необходимая для получения кристаллической решетки. Поэтому «длинные» шлаки не кристаллизуется, а переходят в стекловидную аморфную массу.
«Длинные» шлаки являются кислыми. Чем больше содержание SiO2 в шлаке, тем выше его вязкость. Силикаты, входящие в шлак, могут иметь различную вязкость. Силикаты по возрастанию вязкости можно расположить в такой ряд:

Наиболее сильно повышает вязкость  .
.
«Длинные» шлаки являются менее активными по отношению к металлу и отличаются худшими формирующимися свойствами.
От вязкости шлака зависит его газопроницаемость, т.е. способность пропускать выделяющиеся из металла газы. Если шлаки имеют плохую газопроницаемость, то на поверхности металла создается повышенное давление газов, препятствующее их дальнейшему выделению. В шве наблюдается пористость, на поверхности шва мелкие вмятины, штриховатость, побитость.
Густые шлаки обладают плохой, а маловязкие подвижные шлаки − высокой газопроницаемостью. В жидкотекучих шлаках быстрое выделение газов из металла сопровождается попутным «захватом» частиц шлаковых включений и более полным очищением металла шва.
Отличным разжижителем шлаков является CaF2. Уменьшают вязкость окислы TiO2, K2O, Na2O, MnO, хлориды. TiO2 способствует получению короткого шлака. Таким образом, для сварки более желательны маловязкие легкоподвижные, быстро затвердевающие шлаки
После затвердевания шлаки должны легко удаляться с поверхности шва. Легкость удаления шлаковой корки зависит от окислительной способности шлаки.
Повышенная окислительная способность резко ухудшает отделяемость шлаковой корки от поверхности шва. Действительно, если концентрации окислов железа в шлаке повышена, окисление поверхностных слоев металла может происходить вплоть до его затвердевания. На поверхности металла образуется окисная пленка, состоящая главным образом из FeO, кристаллизирующейся в кубической системе.
Кристаллическая решетка FeO строится на базе кубической решетки α−Fe, поэтому окисная пленка прочно удерживается на поверхности металла шва.
Наличие в шлаковом покрове соединений, кристаллизующихся в этой же кубической системе, что и FeO, приводит к достраиванию этими соединениями решетки закиси железа, а значит, к достаточно прочному сцеплению шлака с металлом. По кубической системе кристаллизируются соединения типа шпинелей, представляющие собой сложные окислы двух− и трехвалентных металлов: Al, Mg, Fe. (Например Fe(Al, Cr, Fe)2O3.
Шпинель образуется преимущественно из FeO и Al2O3/
Минералогический состав шлака влияет на сцепление с металлом. (Надо усилить раскисление металла сварочной ванны, вводя раскислители).
Характеристика важнейших простых окислов, входящих в состав шлаковой фазы
1). SiO2 (Тпл = 1718о С; γ = 2,32 г/см3) − сильный кислый окисел, который легко вступает в реакцию с основными окислами, образуя комплексные соединения − силикаты. SiO2 повышает вязкость шлака и способствует получению длинных, густых шлаков. SiO2 нерастворима в металле.
2). Закись марганца MnO (Тпл = 1785о С; γ = 5,18 − 5,36 г/см3) − основной окисел, образующийся в комплексные соединения с кислыми окислами. Связывает серу в сульфид марганца и повышает ее растворимость в шлаке. Понижает немного вязкость шлака. Нерастворима в металле.
3). Закись железа FeO (Тпл = 1377о С; γ = 5,7 г/см3) − слабый основной окисел, образует комплексные соединения с кислыми окислами (силикаты, титанаты, бораты). Вступает в обменные реакции с элементами, у которых больше сродство к кислороду. FeO растворима в шлаке и в металле.
4). TiO2 (Тпл = 1825о С; γ = 4,18 − 4,25 г/см3) − кислый окисел, образует с основными окислами легкоплавкие подвижные комплексы − титанаты способствует получению короткого шлака, обладающего высокой газопроницаемостью. Нерастворима в металле.
5). CaO (Тпл = 2570о С; γ = 3,4 г/см3) − сильный основной окисел, образующий комплексные соединения. Очень прочен, диссоциирует весьма слабо. Связывает серу и фосфор, облегчая переход их в шлак. Повышает вязкость шлков. Нерастворима в металле.
6). Окись алюминия Al2О3 (Тпл = 2030о С; γ = 3,6 − 4,0 г/см3) − амфотерный окисел, реагирующий с кислыми и основными окислами. Повышает вязкость шлаков, склонна к образованию шпинелей. Нерастворима в металле.
7). Фосфорный ангидрид Р2О5 − кислый окисел, образует комплексные соединения. Особенно активен с СаО.
 2017-10-25
2017-10-25 2941
2941








