1). Система CaF2 используется в качестве флюса для электродуговой сварки аустенитных хромоникелевых сталей (АНФ−1), а также при электрошлаковой сварке титана Тпл CaF2 = 1411о С.
2). Система CaF2−NaF (флюс АНФ−5) Тпл = 950−970о С. Применяется для электродуговой сварки аустенитных хромоникелевых сталей.
3). Система KCl−NaCl−Na3AlF6. Применяется в флюсах и электродных покрытиях для сварки алюминия и некоторых его сплавов. Тпл = 600−700о С.
Системы сварочных шлаков оксидно−солевого типа
1). Система CaF2−Al2O3 применяется при производстве флюсов для ЭШП легированных сталей (АНФ−6).
2). Система CaF2−CaO−SiO2 применяется в сварочных шлаках, образующихся при плавлении электродов фтористокальциевого типа УОНИИ−1, а также в магнитных флюсах марки ФМК−3 и др.
3). Система CaF2−CaO(MgO)−Al2O3−SiO2 используется в низкокремнистых флюсах, применяемых для сварки легированных сталей. Флюсы АН−22, АН−26, др.
Компоненты шлаков могут вступать в химические взаимодействия с металлом на границе раздела жидких фаз. Направление реакций будет определяться не только стандартным химическим сродством (ΔGo), но и соотношением концентраций этих компонентов в соприкасающихся растворах: металлическим и шлаковым.
Но понятие концентрации в этому случае нужно заменить активностью, т.к. одно и то же количество компонента в шлаке, содержащим избыток кислотных окислов (SiO2, TiO2), будет вести себя иначе, чем в шлаке, содержащем избыток основных окислов (CaO, MnO).
При избытке в шлаке кислых окислов (SiO2, TiO2), окислы основного характера будут связаны в силикаты или алюмосиликаты и активность их будет понижена, а находящиеся в избытке кислые окислы буду, наоборот, активно вступать в химические реакции.
В шлаках с избытком основных окислов (CaO, MnO) кислые окислы будут связаны в соли, а основные окислы будут реагировать с металлом.
Кислые шлаки: 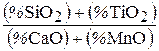 >1.
>1.
Основные шлаки: 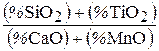 <1.
<1.
Взаимодействие компонентов шлака с металлической фазой можно рассматривать с двух точек зрения, а именно с термодинамической, изучающей лишь начальные и конечные состояние системы, и электрохимической, рассматривающей процесс взаимодействия ионов с металлической поверхностью при наличии скачка потенциала металл−электролит или внешней разности потенциалов.
В металлургии сварочных процессов, идущих при температурах, значительно превышающих температуру плавки стали в печах, активность компонентов шлаковых систем значительно выше окислительно−восстановительных реакций на границе металл−шлак идут интенсивнее, чем при плавке в мартеновских электропечах.
Увеличение активности компонентов шлака при сварке можно объяснить с двух точек зрения, а именно: рассматривая шлак как раствор реагирующих между собой веществ и как электролит.
1). Рассматривая шлак как реагирующие между собой окислы в растворе, можно утверждать, что при повышении температуры диссоциация силикатов, алюминатов и алюмосиликатов будет увеличиваться, т.к. все эти соединения являются экзотермическими.
CaSiO3→CaO + SiO2 (ΔH<0).
(CaO + SiO2)→ CaSiO3 − метасиликат.
Таким образом активная концентрация SiO2 будет возрастать и Si получит возможность при сварке перейти в металл из нейтральных и даже основных шлаков (в очень малых количествах, чего нет в сталеплавильном процессе).
SiO2 +2Fe →[Si] +2FeO
2). При рассмотрении шлака как электролита следует помнить, что электропроводность растет, а вязкость снижается (при повышении То). Это свидетельствует о том, что число ионов в единице объема электролита возрастает и уменьшается взаимодействие между ними.

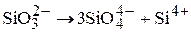
Увеличение активной концентрации иона Si4+ облегчает ему переход в металл, изменяя разность потенциалов на границе металл−шлак:
Si4+ +2Fe0→[Si0] +2Fe2+.
1.2. Распределение марганца между шлаком и металлом
при рассмотрении процессов сварки под слоем плавленых сварочных флюсов всегда особенно интересен переход Mn в состав металла шва, полезный при сварке малоуглеродистых и низкоуглеродистых сталей и часто ухудшающий свойства металла шва при сварке высоколегированных специальных сталей.  .
.
 ;
; 
или  .
.
Концентрация Mn в металле будет возрастать при увеличении % MnO в шлаке и при уменьшении %FeO, что учитывается при составлении рецептуры сварочных флюсов (флюс АН−348 и др.).
Марганец находящийся в шлаке в виде закиси марганца (MnO), может восстанавливаться железом, в меньшей степени никелем и медью по обратимой реакции:
 ;
;  кДж (при высоких температурах равновесие смещается в сторону восстановления марганца и окисления железа).
кДж (при высоких температурах равновесие смещается в сторону восстановления марганца и окисления железа).
Для реакции, протекающей между металлом и шлаком, можно предложить две схемы.
Первая схема рассматривает взаимодействие металла и шлака, представляя шлак как окислы различных компонентов, реагирующих между собой.
Шлак (MnO) (FeO)
Металл  (а)
(а)
Mn переходит в раствор металла, а FeO распределяется между металлом и шлаком согласно закону распределения.
Константа равновесия обратимой реакции (а):
 ,
,  ,
,  ,
,  .
.
1).  - ввиду неограниченной растворимости в железе и близости их атомных масс.
- ввиду неограниченной растворимости в железе и близости их атомных масс.
2). 
3).  .
.
Последнее преобразование можно сделать в соответствии с законом распределения, который для данного случая можно записать

 (для железистых шлаков).
(для железистых шлаков).
 будет постоянной для данного шлака.
будет постоянной для данного шлака.
Таким образом [%FeO]=L(%FeO), а так как шлак может вообще состоять только из FeO, ввиду неограниченной его растворимости, то можно считать (%FeO) насыщ. = 100%, что и сделано в примере 3.
Из выражения (а) можно определить содержание Mn в металле

Это учитывается при составлении рецептуры сварочных флюсов (ОСЦ-45, АНЗ-48 и др.).
С повышением То содержание Mn в металле шва будет расти, т.к.
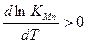 и ΔН>0.
и ΔН>0.
Поэтому при высокотемпературных процессах  сварки переход марганца из флюсов в металл шва весьма значителен.
сварки переход марганца из флюсов в металл шва весьма значителен.
Вторая схема этого процесса исходит из ионной теории строения шлак, рассматривая его как электролит, а окислительно-восстановительный процесс, - как работу гальванического элемента.
Как электролит можно представить
 ;
;
 .
.
Ионы марганца из шлака будут подходить к поверхности жидкого железа и вступать в реакцию:
 .
.
Марганец переходит в железо до определенной концентрации, при которой его активность сделается равной активности железа.
Так как окислительно-восстановительные процессы развиваются в приэлектронном слое, то общую схему процесса можно представить следующим образом:




Как видно из схемы, состав шлака сильно влияет на переход марганца, т.к. содержание ионов Fe2+ в шлаке придает ему окислительный характер и смещает равновесие в обратную сторону. Кроме того, избыток ионов  задерживает диссоциацию силикатов или понижает активность ионов Mn2+ и Fe2+, поэтому в кислых шлаках переход марганца будет меньше.
задерживает диссоциацию силикатов или понижает активность ионов Mn2+ и Fe2+, поэтому в кислых шлаках переход марганца будет меньше.
 2017-10-25
2017-10-25 840
840








