Кислотами называются химические соединения, содержащие в своём составе атомы водорода, способные замещаться на атомы металлов. В воде большинство кислот (НА) распадается (диссоциирует) на ионы водорода (Н+) и кислотного остатка (А-).

 НА Н+ + А-
НА Н+ + А-
По степени диссоциации в воде различают сильные, практически полностью распадающиеся на ионы (азотная, соляна, серная), средние (фосфорная, плавиковая) и слабые, практически не диссоциирующие в воде кислоты (уксусная, борная). Кислоты можно обнаружить по изменению цвета некоторых веществ – индикаторов. Например, лакмус в кислотах – красный, фенолфталиен – бесцветный, метилоранж – оранжевый.
Кислоты оказывают сильное действие на организм человека и животных, т.к. обладают водоотнимающим действием и, изменяя щелочную реакцию протоплазмы живой клетки на кислую, осаждают белки. Действие кислоты на живой организм зависит от вида и концентрации кислоты. Под действием кислот может происходить раздражение и полное разрушение тканей.
В контакте с кислотами многие металлы подвергаются коррозии. Для защиты от разрушения применяют стойкие к действию кислот металлы, сплавы, силикатные и полимерные материалы. Для эти х же целей в кислоты иногда вводят специальные вещества – ингибиторы, которые уменьшают или устраняют коррозионное действие кислоты. Различают органические и неорганические кислоты.
По масштабам производства неорганические кислоты значительно превосходят органические. Они широко применяются во многих отраслях промышленности. Среди неорганических кислот наибольшее распространение в народном хозяйстве получила серная кислота.
Серная кислота является одним из основных продуктов химической промышленности и широко применяется во многих производствах. Она принадлежит к числу сильных неорганических кислот и является самой дешёвой из них (более чем в 2 раза дешевле азотной и соляной кислот).
Основное количество серной кислоты расходуется на производство минеральных удобрений (суперфосфата, сульфата аммония, нитрофоса, нитрофоски и др.). Вторым по величине потребителем является нефтепереработка, где серная кислота расходуется для очистки нефтепродуктов. Большие количества кислоты используются в металлургии цветных металлов, в гальванотехнике, в производстве других кислот (соляной, фосфорной, плавиковой, борной, хромовой, уксусной, лимонной и др.), для получения сульфатов металлов, простых и сложных эфиров, крахмала, сахара, для дубления кож, для снаряжения аккумуляторов и многих других целей. В смеси с азотной кислотой серная кислота используется для нитрования органических соединений при получении взрывчатых веществ и красителей.
В технике под серной кислотой понимают любые смеси оксида серы (VI) с водой. Состав такой «серной кислоты» можно отразить формулой
x H2O + y SO3 (где x,y > 0).Если соотношение 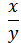 > 0 – имеют дело с водным раствором серной кислоты, если
> 0 – имеют дело с водным раствором серной кислоты, если  0 – с олеумом, раствором оксида серы (VI) в серной кислоте.
0 – с олеумом, раствором оксида серы (VI) в серной кислоте.
Безводная серная кислота или моногидрат при 200С представляет собой маслянистую жидкость с плотностью 1820 кг/м3. Температура кристализации моногидрата +10, 450С, кипения +296,20С при атмосферном давлении.
С водой и оксидом серы (VI) серная кислота смешивается в любых соотношениях, образуя промежуточные соединения состава H2SO4*nH2O (где n=4.2,1) и H2SO4*mSO3 (где m= 1,2). Рассматривая химические свойства серной кислоты, следует различать поведение разбавляемой и концентрированной кислот. Так, разбавленная кислота реагирует со всеми (за исключением свинца) металлами, стоящими в ряду активности правее водорода.
На поверхности свинца в контакте с разбавленной серной кислотой образуется плотная нерастворимая в кислоте плёнка сульфата, препятствующая дальнейшему растворению металла.
Концентрированная же серная кислота, обладая сильным окислительным действием, реагирует с металлами не непосредственно, а через промежуточную стадию образования оксида. В результате взаимодействия образуются сульфаты соответствующих металлов, оксид серы (IV) и вода.
По действием концентрированной кислоты легко (особенно при нагревании) растворяются такие металлы, стоящие в ряду активности после водорода, как медь, ртуть, серебро и другие. В то же время железо, хром, алюминий и даже кальций не разрушаются концентрированной кислотой, т.к. образующиеся на поверхности этих металлов оксидные плёнки имеют более плотную структуру и препятствуют непосредственному контакту металлов с кислотой. Это явление получило название пассивирования.
Концентрированная кислота и олеум отличаются высоким сродством к воде. При смешивании их с водой выделяется большое количество тепла. Сильное водоотнимающее действие серной кислоты проявляется в её способности поглощать пары воды из воздуха. На этом основано применение концентрированной серной кислоты для сушки газов.
Многие органические соединения в контакте с концентрированной серной кислотой, теряя воду, обугливаются.
Устойчивыми к действию серной кислоты являются эмали (до температуры кипения растворов любых концентраций, винипласт (до 600С при действии 80%-ной H2SO4), полиизобутилен (до 20-600С в зависимости от концентрации кислоты), полиэтилен (до 800С при действии 70%-ной кислоты), фторопласт – 4 (до 2500С). При нагревании до 4000С серная кислота практически полностью диссоциирует на воду о оксид серы (VI).
Серную кислоту в настоящее время производят двумя способами: контактным и нитрозным, или башенным.
В основе контактного способа лежит реакция окисления оксида серы (IV) в оксид серы (VI), протекающая на поверхности твёрдого катализатора

 2 SO2 + O2 2SO3 + Q1
2 SO2 + O2 2SO3 + Q1
Образовавшийся оксид серы (VI), поглощаясь водой, превращается в серную кислоту

 SO3 + H2O H2SO4 +Q2
SO3 + H2O H2SO4 +Q2
Сущность нитрозного способа состоит в окислении оксида серы (IV) смесью оксидов азота NO2 и N2O3 в присутствии воды. Не разбирая подробно механизма этого сложного процесса, представим его следующей схемой:

 SO2 + NO2 (N2O3) + H2O H2SO4 + NO (2NO)
SO2 + NO2 (N2O3) + H2O H2SO4 + NO (2NO)
Нитрозный способ по сравнению с контактным обладает рядом недостатков: во первых, он не позволяет получить серную кислоту с концентрацией больше 75%, во-вторых, получаемая кислота содержит много примесей и пригодна только для производства минеральных удобрений, наконец, производство кислоты нитрозным способом связано с выбросом в атмосферу большого количества оксидов азота, оказывающих вредное воздействие на окружающую среду. В связи с этим в нашей стране прекращено строительство сернокислых заводов, работающих по нитрозному способу, и более 90% производимой серной кислоты получают на контактных установках.
В качестве сырья для получения серной кислоты, в принципе, могут быть использованы любые вещества, содержащие серу. Чаще других используется серный колчедан FeS2 (около 45% производимой серной кислоты), элементарная сера, отходящие газы заводов цветной металлургии и газы нефтедобычи и нефтепереработки. В последние годы наметилась тенденция увеличения доли отходящих газов цветной металлургии и попутных газов нефтедобычи в общем балансе сырья для производства серной кислоты.
Технологический процесс производства серной кислоты контактным способом включает четыре основные стадии: обжиг серусодержащего сырья, очистка обжигового газа, контактное окисление оксида серы (IV) и абсорция оксида серы (VI).
Учитывая, что основным источником сырья для производства серной кислоты в нашей стране является серный колчедан, принципиальную схему контактного способа производства серной кислоты упрощённо можно представить следующим образом (рис.1).
1) обжиг серосодержащего сырья;
2) очистка обжигового газа от примесей;
3) контактное окисление оксида серы (IV) в оксид серы (VI);
4) поглощение оксида серы VI водой и получение серной кислоты.
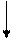


 Q Пыль Примеси Q Катализатор
Q Пыль Примеси Q Катализатор
|
|


|
 | |||||||
 |  | ||||||
 | |||||||
 Колчедан
Колчедан
 Разбавленная серная кислота
Разбавленная серная кислота
Огарок
|

 Концентрированная серная кислота
Концентрированная серная кислота
Рис. 1 Принципиальная схема производства серной кислоты
Обжиг серного колчедана, протекающий по уравнению реакции 4 FeS2 + 1102 = 2 Fe2O3 + 8SO2 + Q, является типичным гетерогенным процессом. Для его осуществления используются печи трех типов: механические полочные, печи пылевидного обжига и печи кипящего слоя (КС). Последние являются наиболее эффективными и постепенно становятся основным видом оборудования для обжига серного колчедана. Оптимальные условия обжига колчедана выбираются с учётом установленных экспериментально зависимостей скорости реакции, от размеров частиц обжигаемого колчедана, температуры и потока воздуха, подаваемого в печь.
На второй стадии обжиговый газ очищается от механических примесей и оксидов селена и мышьяка в скрубберах и электрофильтрах (стадия 2). Контактное окисление оксида серы (IV) в оксид серы (VI) (стадия 3) является обратимым, гетерогенно-каталитическим, экзотермическим процессом, протекающим с уменьшением газового объёма. В реальных условиях процесс контактного окисления ведут в политермическом режиме, начиная при относительно высоких температурах и заканчивая при относительно низких температурах. В промышленности нашли распространение полочные контактные аппараты и аппараты с кипящим слоем катализатора. Наиболее эффективными катализаторами оказались ванадиевые контактные массы, состоящие из оксида ванадаия (V), нанесённого на пористые носители.
Заключительная стадия (стадия 4) процесса осуществляется в скрубберах с насадкой, орошаемых в начале олеумом, а затем 98,3%-ной серной кислотой, имеющей наивысший коэффициент поглощения SO3. Процесс абсорции проводят при температурах 30…600С при атмосферном давлении. Качество выпускаемой в настоящее время серной кислоты регламентируется четырьмя государственными стандартами. В таблице 2.1. приведены некоторые технические требования, предъявляемые к серной кислоте государственными стандартами 2184-77 (Кислота серная техническая), 667-73 (Кислота серная аккумуляторная), 4204-77 (Кислота серная) и 14262-78 (Кислота серная особой чистоты). В каждом из ГОСТов подробно описываются методы, с помощью которых определяются физико-химические свойства серной кислоты.
Таблица 1. – Физико-химические свойства серной кислоты
| ГОСТ | Показатели Физико-химические свойства серной кислоты | Внешний вид | Массовая доля моногидрата,% | Массовая доля свободного окисла серы (VI), % | Массовая доля железа, %, не более | Массовая доля остатка после прокаливания, %, не более |
| 2184-77 | 1. Контактная улучшенная (высший сорт) | - | 92,5-94,0 | - | 0,007 | 0,02 |
| 2. Контактная улучшенная (1-й сорт) | - | 92,5-94,0 | - | 0,015 | 0,03 | |
| 3. Контактная техническая (1-й сорт) | - | 92,5 | - | 0,02 | 0,05 | |
| 4. Контактная техническая (2-й сорт) | - | 92,5 | - | 0,1 | - | |
| 5. Олеум улучшенный (высший сорт) | Механических примесей нет | - | 0,007 | 0,02 | ||
| 6. Олеум улучшенный (1-й сорт) | Маслянистая жидкость с опалесценцией | - | 0,01 | 0,03 | ||
| 7. Олеум технический | - | - | - | - | ||
| 8. Башенная | - | - | 0,05 | 0,3 | ||
| 9. Регенерированная | - | - | 0,2 | 0,4 | ||
| 667-73 | 10. Аккумуляторная (высший сорт) | - | 92-94 | - | 0,005 | 0,02 |
| 11. Аккумуляторная (1-й сорт) | - | 92-94 | - | 0,006 | 0,03 | |
| 12. Аккумуляторная (2-й сорт) | - | 92-94 | - | 0,012 | 0,04 | |
| 4204-77 | 13. Реактивная (ч) | - | - | - | - | - |
| 14. Реактивная (х.ч.) | - | - | - | - | - | |
| 15. Реактивная (ч.д.а.) | - | - | - | - | - | |
| 14262-78 | 16.Особой чистоты (осч 20-4) | Неотличима от дистиллированной воды в пробирке диаметром 20 мм | 93,5-95,5 | - | 2*10-6 | 5*10-4 |
| 17. Особой чистоты (осч 11-5) | 93,5-95,5 | - | 3*10-6 | 5*10-4 | ||
| 18. Особой чистоты (осч 5-5) | 93,5-95,5 | - | 1*10-5 | 5*10-4 |
 2017-10-25
2017-10-25 1556
1556
