Закон эквивалентов».
Расчет массовой доли растворенного вещества
Задача 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) = 
Масса раствора m(р-ра) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) =  = 0,125 или 12,5%
= 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Задача 2. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4·7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение:
ω(FeSO4) = 
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO4·7H2O) + m(H2O) = 41,7 + 258,3 = 300 г
Далее определяем массу FeSO4:
m(FeSO4) = n(FeSO4)·m(FeSO4) = n(FeSO4·7H2O)·m(FeSO4) =
=  ·m(FeSO4) =
·m(FeSO4) =  = 22,8 г,
= 22,8 г,
ω(FeSO4) =  = 0,076 или 7,6%
= 0,076 или 7,6%
Ответ: ω(FeSO4) = 0,076 или 7,6%.
Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие
Задача 3. Вычислите молярную, нормальную (молярную концентрацию эквивалента), моляльную концентрации 8% раствора  (плотность раствора 1100 кг/м3 = 1100г/л = 1,1 г/мл). Определите титр и молярную долю
(плотность раствора 1100 кг/м3 = 1100г/л = 1,1 г/мл). Определите титр и молярную долю  в растворе.
в растворе.
Решение:
1)  ; 2)
; 2)  ; 3)
; 3) 
 ;
;


Ни в одной из записанных формул, не знаем двух величин. Можно взять для расчета конкретную массу раствора (например, 100г) или конкретный объем раствора (например, 1л = 1000 мл).
|
|
|
Пусть Vр-ра=1 л =1000мл
Тогда m р-ра =ρр-ра·Vр-ра = 1,1· 1000 = 1100 г.
Из (1): 

По (2):  .
.

По (3):  .
.

По (4): 
По (5): 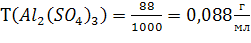
 р-ль – H2O, т.к. о нем ничего не говорится. По (6):
р-ль – H2O, т.к. о нем ничего не говорится. По (6):  N
N  .
.
Задача 4. Рассчитать молярную и молярную концентрацию эквивалента раствора мышьяковой кислоты (H3AsO4). Плотность раствора 1,08 г/мл, массовая доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4 =  ; z =3. MЭ (H3AsO4) =
; z =3. MЭ (H3AsO4) =  М(H3AsO4).
М(H3AsO4).
СМ(H3AsO4) = ν (H3AsO4)/ Vр-ра; СН(H3AsO4) = z·СМ(H3AsO4)
Объем раствора принимаем равным 1 л = 1000 мл.
m(H3AsO4) = Vр-ра·ρр-ра·ω(H3AsO4) = 1000·1,08·0,09 = 97,2 г
ν(H3AsO4) =  =
= 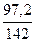 = 0,68 моль
= 0,68 моль
СМ(H3AsO4) =  = 0,68 моль/л; Сн.(H3AsO4) = 3·0,68 = 2,04 моль/л
= 0,68 моль/л; Сн.(H3AsO4) = 3·0,68 = 2,04 моль/л
Ответ: СM(H3AsO4) = 0,68 моль/л, СН(H3AsO4) = 2,04 моль/л.
Задача 5. Рассчитать массовую долю 1,25 н. раствора фосфорной кислоты, если плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) = 
Объем раствора принимаем за 1 л (1000 мл). Тогда масса раствора равна:
mр-ра = Vр-ра·ρр-ра = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4 =  ; z =3. MЭ(H3РO4) =
; z =3. MЭ(H3РO4) =  М(H3РO4).
М(H3РO4).
Число эквивалентов вещества: νэкв. (H3PO4) = Cн.(H3PO4)·Vр-ра = 1,25·1 = 1,25 моль.
Масса H3PO4 в растворе:
m(H3PO4) = ν (H3PO4)·MЭ(H3PO4) = ν (H3PO4)·  ·M (H3PO4);
·M (H3PO4);
m(H3PO4) = 1,25·  ·98 = 40,83 г
·98 = 40,83 г
Массовая доля H3PO4 в растворе: ω(H3PO4) = 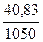 = 0,039 или 3,9%
= 0,039 или 3,9%
Ответ: ω(H3PO4) = 0,039 или 3,9%.
 2017-10-25
2017-10-25 3575
3575







