Задача 11. Вычислить, сколько граммов исходного вещества Na2CO3 следует взять для приготовления 500 мл 0,10 н раствора.
Решение:
1. При установлении концентрации растворов кислот по исходному веществу Na2CO3 происходит реакция:
Na2CO3 + 2H+ = CO2↑ + H2O + 2Na+
В реакции происходит полное замещение катионов натрия на катионы водорода, поэтому фактор эквивалентности ( ) для карбоната натрия равен:
) для карбоната натрия равен:
 (Na2CO3) =
(Na2CO3) = 
2. Определим массу Na2CO3, необходимого для приготовления 500 мл 0,1 н раствора. Из формулы для расчёта нормальной концентрации выразим массу Na2CO3:
m(Na2CO3) =  =
=  = 2,6485 г
= 2,6485 г
Задача 12. Вычислить титр приготовленного раствора серной кислоты, если на титрование раствора навески исходного вещества Na2CO3, равной 0,5507 г, израсходовано 10,70 мл приготовленного раствора H2SO4.
Решение:
1. Уравнение реакции:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
На основании закона эквивалентов:
nэкв(Na2CO3) = nэкв(H2SO4)
Так как в результате происходит полное замещение катионов Na+ на катионы H+, то
nэкв(Na2CO3) =  (Na2CO3) =
(Na2CO3) = 
nэкв(H2SO4) =  (H2SO4) =
(H2SO4) = 
Количество эквивалентов Na2CO3 определяется по формуле:
n  (Na2CO3) =
(Na2CO3) =  =
=  =
=  = 0,0104 моль
= 0,0104 моль
M(Na2CO3) = 105,94 
2. Исходя из закона эквивалентов, определим эквивалентную концентрацию H2SO4:
n  (Na2CO3) = n
(Na2CO3) = n  (H2SO4)
(H2SO4)
n  (Na2CO3) = С
(Na2CO3) = С  (H2SO4)
(H2SO4)  V(H2SO4)
V(H2SO4)
С  (H2SO4) =
(H2SO4) =  =
=  = 0,9716
= 0,9716 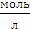
3. Из формулы для расчёта эквивалентной концентрации найдём массу H2SO4, содержащуюся в 10,70 мл раствора:
m(H2SO4) =  =
=  = 0,5097 г
= 0,5097 г
M(H2SO4) = 98,06 
4. Титр раствора (Т) – это количество грамм растворённого вещества, содержащегося в 1 мл раствора. Рассчитаем титр раствора H2SO4:
Т =  =
=  = 0,04764
= 0,04764 
Задача 13. Определить титр приготовленного раствора серной кислоты, если на титрование 10,0 мл этого раствора израсходовано 9,4 мл 0,1 н раствора карбоната натрия.
Решение:
1. Уравнение реакции:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
На основании закона эквивалентов:
nэкв(Na2CO3) = nэкв(H2SO4)
Сн(Na2CO3) × V(Na2CO3) = Сн(H2SO4) × V(H2SO4),
Отсюда Сн(H2SO4) равна:
Сн(H2SO4) =  =
=  = 0,094
= 0,094 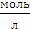
2. Титр раствора H2SO4 вычислим по формуле:
T(H2SO4) =  =
=  = 0,004608 (
= 0,004608 ( )
)
Мэкв(H2SO4) =  × m(H2SO4) =
× m(H2SO4) =  × 98,06 = 49,03
× 98,06 = 49,03 
Задача 14. Вычислить, сколько граммов NaOH содержится в 0,5 л раствора, если на титрование 10,0 мл этого раствора израсходовано 8,20 мл раствора H2SO4, титр которого равен 0,04407 
Решение.
1. Уравнение реакции: 2NaOH + H2SO4 → Na2SO4 + H2O
По уравнению реакции определим факторы эквивалентности реагирующих веществ:
 (H2SO4) =
(H2SO4) =  ;
;  (NaOH) =
(NaOH) = 
2. Вычислим нормальную концентрацию раствора H2SO4 по формуле:
С  (H2SO4) =
(H2SO4) = 
так как Т =  ,
,
то m(H2SO4) = T(H2SO4)  V(H2SO4),
V(H2SO4),
тогда
С  (H2SO4) =
(H2SO4) =  =
=  ,
,
где 1000 – коэффициент пересчёта миллилитров в литры.
С  (H2SO4) =
(H2SO4) =  = 0,8988 н
= 0,8988 н
2. По закону эквивалентов:
n  (H2SO4) = n(NaOH)
(H2SO4) = n(NaOH)
С  (H2SO4)
(H2SO4)  V(H2SO4) = С(NaOH)
V(H2SO4) = С(NaOH)  V(NaOH)
V(NaOH)
С(NaOH) =  =
=  = 0,7370 н
= 0,7370 н
3. Рассчитаем массу NaOH, содержащегося в 0,5 л раствора по формуле:
m(NaOH) =  =
=  = 14,74 г
= 14,74 г
 2017-10-25
2017-10-25 8989
8989
