Задача 7. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 = 96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96 = 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) = 704 г.
Задача 8. Определите массу кристаллогидрата CuSO4·5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) = 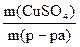 =
= 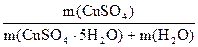
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) = 
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400 = 32 г.
n(CuSO4) = 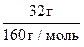 = 0,2 моль.
= 0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г, m(H2O) = 350 г.
Задача 9. Вычислить, сколько мл 70% раствора серной кислоты с плотностью 1,611 г/см3 необходимо взять для приготовления 20,0 л 0,10 н. раствора.
Решение:
При решении задач подобного типа необходимо учитывать, что массы веществ в концентрированном и разбавленном растворах равны между собой.
mв-ва в конц. р-ре = mв-ва в разб. р-ре
1. Рассчитаем массу H2SO4, необходимую для приготовления разбавленного раствора объемом 20,0 л с концентрацией 0,10 н. Из формулы для расчёта эквивалентной концентрации раствора (Сн)
Сн = 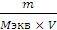 , где
, где
m – масса растворённого вещества, г;
Mэкв – эквивалентная масса, г;
V – объём раствора, л.
вычислим массу серной кислоты:
m(H2SO4) = Сн × Мэкв(H2SO4) × V = 0,10 × 49,03 × 20,0 = 98,06 (г)
Мэкв(H2SO4) =  × m(H2SO4) =
× m(H2SO4) =  × 98,06 = 49,03
× 98,06 = 49,03 
2. Из формул для расчета массовой доли вещества:
ω=  · 100%, находим массу концентрированного раствора серной кислоты.
· 100%, находим массу концентрированного раствора серной кислоты.
m р-ра (H2SO4) =  =
= 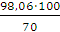 = 140,09 г.
= 140,09 г.
3. Находим объем концентрированного раствора серной кислоты:
V(H2SO4) =  =
=  = 86,96 мл
= 86,96 мл
Задача 10. В какой массе эфира надо растворить 3,04г анилина C6H5NH2, чтобы получить раствор, моляльность которого 0,3 моль/кг?
Решение: Моляльная концентрация раствора Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1кг растворителя:
Сm р.в. = ν р.в. / mр-ля,
где ν р.в. – количество растворенного вещества, моль;
m р-ля – масса растворителя, кг.
Масса растворителя (эфира) рассчитывается по формуле:
m р-ля = ν (C6H5NH2) / Сm(C6H5NH2);
ν (C6H5NH2) = m(C6H5NH2) / M(C6H5NH2);
M(C6H5NH2) = 93 г/моль.
Тогда m(эфира) = 3,04г / (93 г/моль· 0,3 моль/кг) =0,109 кг.
 2017-10-25
2017-10-25 1548
1548








