Допустим, что некоторая система (газ, заключённый в цилиндре под поршнем), обладая внутренней энергией, получила некоторое количество теплоты Q, перейдя в новое состояние, характеризуемой внутренней энергии U2 , совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, и отрицательным, когда забирается у системы. Работа положительна, когда она совершается газом против внешних сил, и отрицательна, когда она совершается над газом. 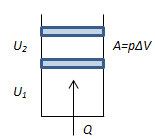
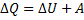

I начало термодинамики: Количество тепла (ΔQ), сообщённой системе идёт на увеличение внутренней энергии системы и на совершение системой работы (А) против внешних сил.
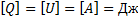
Запись I начало термодинамики в дифференциальной форме
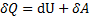
dU - бесконечно малое изменение внутренней энергии системы
 - элементарная работа,
- элементарная работа,  - бесконечное малое количество теплоты.
- бесконечное малое количество теплоты.
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии равно нуля. Тогда

т. е. вечный двигатель I рода, периодически действующий двигатель, который совершал бы большую работу, чем сообщённая ему извне энергия, невозможен (одна их формулировок I начало термодинамики).
Число степеней свободы молекулы. Закон о равномерном
 2017-12-14
2017-12-14 635
635








