Число степеней свободы: механической системы называется количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z).
Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью (N2, O2, Н2) имеют 3 поступательные степени свободы и 2 вращательные степени свободы: i=iпост +iвр=3 + 2=5.
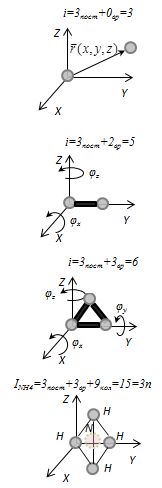
Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные - с поворотом молекулы как целого. Вращение относительного осей координат x и z на угол 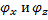 приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение, следовательно, координата φy в данном случае не нужна. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы
приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение, следовательно, координата φy в данном случае не нужна. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы
 i=iпост +iвр=3 + 3=6
i=iпост +iвр=3 + 3=6
Если связь между атомами не жесткая, то добавляются колебательные степени свободы. Для нелинейной молекулы ікол . = 3N - 6, где N - число атомов в молекуле.
Независимо от общего числа степеней свободы молекул 3 степени свободы всегда поступательные. Ни одна из поступательных степеней не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равна 1/3 значения 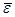
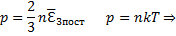
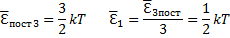
Больцман установил закон, согласно которому для статистической системы (т. е. для системы у которой число молекул велико), находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинематическая энергия, равная 1/2 kT, и на каждую колебательную степень свободы - в среднем энергия, равная kT. Колебательная степень свободы «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движения), но и потенциальная энергия, причем 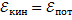 таким образом средняя энергия молекулы
таким образом средняя энергия молекулы
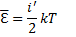
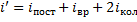
Мы будем рассматривать молекулы с жесткой связью, поэтому
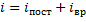
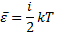
так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы не взаимодействуют между собой), то внутренняя энергия 1 моля равна произведению средней энергии одной молекулы на число молекул в моле вещества, то есть на число Авогадро
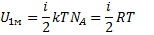
Для 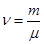 молей газа
молей газа
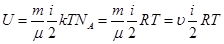
 2017-12-14
2017-12-14 886
886








