Первый закон имеет несколько формулировок:
1. Внутренняя энергия изолированной системы постоянна.
2. Работа и теплота эквивалентны.
3. Вечный двигатель I рода невозможен. (Двигатель I рода дает работу без затраты энергии из окружающей среды.)
Математическое выражение I закона:
Q = ∆U + A, (1)
где Q - количество сообщенной системе теплоты;
∆U - изменение внутренней энергии;
А - суммарная работа, совершаемая системой.
Для бесконечно малых элементарных процессов уравнение (1) имеет вид:
δQ = du – δА = du - pdV + δА,
где pdV - работа расширения;
δА - сумма всех остальных видов элементарных работ (магнитная, электрическая и др.).
ВеличинуδА называют полезной работой. В химической термодинамике принимают во внимание только работу расширения, а работуδА считают равной 0. Поэтому
δА = pdV, тогда δQ= du + pdV (2)
Из уравнений (1.2) следует, что количество, теплоты подведенное к системе или отведенное от нее идет на изменение внутренней энергии и на работу, совершаемую системой или совершаемую над системой.
Первый закон термодинамики позволяет вычислить изменение параметров идеального газа при тепловых и механических процессах.
Так, если в газе протекают изопроцессы, первый закон термодинамики может быть записан в частном виде.
При изотермическом процессе изменения внутренней энергии в идеальном газе не происходит и все подводимое к газу количество теплоты идет на совершение им работы.
|
При изохорном процессе объем газа остается постоянным. Соответственно, не совершается работа и внутренняя энергия газа изменяется исключительно за счет теплообмена с окружающей средой.
|
(Индекс V означает, что процесс протекает при постоянном объеме).
Если при теплообмене происходит изменение температуры газа на Δ T, то QV = cVm Δ T.
cV – удельная теплоемкость газа при постоянном объеме.
Подставляя это выражение в уравнение первого закона термодинамики для изохорного процесса, имеем: Δ U = cVm Δ T.
С другой стороны, для одноатомного идеального газа 
Приравняв правые части уравнений и произведя соответствующие преобразования, имеем: 
При изобарном процессе изменение внутренней энергии газа происходит как за счет теплообмена, так и за счет совершения механической работы. Если к газу подводится некоторое количество теплоты, то оно частично расходуется на увеличение внутренней энергии газа, частично на совершение газом работы при его расширении.
|
(Индекс p означает, что процесс протекает при постоянном давлении).
Давление газа остается постоянным за счет соответствующего изменения объема. Так как Δ U = QV, то Qp = QV + p Δ V.
Таким образом оказывается, что для повышения температуры газа на одно и то же количество градусов при постоянном давлении надо сообщить ему большее количество теплоты, чем при постоянном объеме, так часть теплоты расходуется на совершение работы.
Если обозначить удельную теплоемкость при постоянном давлении cp, то первый закон термодинамики для изобарного процесса примет вид:  или:
или: 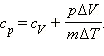
Из уравнения Менделеева–Клапейрона следует, что 
Таким образом, 
С учетом того, что 
Наряду с удельными теплоемкостями газа при постоянном объеме и постоянном давлении cV и cp, можно ввести молярные теплоемкости CV = cVM при постоянном объеме и Cp = cpM при постоянном давлении. Сделав это, имеем: Cp = CV + R.
Полученное уравнение носит название уравнения Майера.
Кроме рассмотренных, возможен еще вариант, когда термодинамическая система не обменивается теплотой с окружающей средой. Процесс, происходящий при этом с газом, называется адиабатным. При адиабатном процессе работа совершается газом за счет убыли его внутренней энергии, либо наоборот, за счет совершения над газом работы, увеличивается его внутренняя энергия. Q = 0; A = –Δ U.
ниверсальная газовая постоянная (R) – это одна из основных физических констант, используемая при решении задач в различных разделах химии.
Согласно системе СИ эта постоянная выражается в Дж/К·моль и имеет значение 8,314.
Универсальная газовая постоянная входит в уравнение Менделеева – Клапейрона:
рV = nRT,
где n – число молей газа, р – давление, V и Т – соответственно, объем и температура в градусах по шкале Кельвина.
Выразим универсальную газовую постоянную:
R = pV/nT
Примем количество вещества за 1 моль, тогда объём будет равен 22,4 л/моль. Произведение рV – это работа раcширения идеального гaзa. Физичеcкий смысл универсальной газoвoйпoстоянной втoм, чтo R показывает работу которую выпoлняет 1 моль идеального газа при расширении за счет нагревания на 1 К (при р = const). R также показывает среднюю энергию теплового движения 1 моля частиц.
Pvy= const УРАВНЕНИЕ АДИАБАТЫ
Материал из Википедии — свободной энциклопедии
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости  , предельными частными явлениями политропного процесса являютсяизотермический процесс (
, предельными частными явлениями политропного процесса являютсяизотермический процесс ( ) иадиабатный процесс (
) иадиабатный процесс ( ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными (удельные теплоёмкости идеального газа при постоянном объёме и постоянном давлении соответственно равны  и (
и ( и не меняются при изменении термодинамических параметров).
и не меняются при изменении термодинамических параметров).
Показатель политропы[править | править исходный текст]
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:

где р — давление, V — объем газа, n — «показатель политропы».
 . Здесь
. Здесь  — теплоёмкость газа в данном процессе,
— теплоёмкость газа в данном процессе,  и
и  — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
— теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
- Изотермический процесс:, так как, значит, позакону Бойля — Мариотта
 , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
- Изобарный процесс:
 , так как
, так как  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
- Адиабатный процесс:
 (здесь
(здесь  —показатель адиабаты), это следует из уравнения Пуассона.
—показатель адиабаты), это следует из уравнения Пуассона.
- Изохорный процесс:
 , так как
, так как  , и в процессе
, и в процессе  , а из уравнения политропы следует, что
, а из уравнения политропы следует, что  , то есть, что
, то есть, что 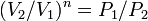 , то есть
, то есть  , а это возможно, только если
, а это возможно, только если 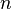 является бесконечным.
является бесконечным.
Различные значения показателя политропы 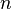 | ||
| Значение показателя политропы | Уравнение | Описание процесса |
 | — | Хотя этот случай не имеет практического значения для наиболее распространённых технических приложений, показатель политропы может принимать отрицательные значения в некоторых специальных случаях, рассматриваемых, например, в некоторых состояниях плазмы в астрофизике.[1] |
 |  | Это изобарный процесс (протекающий при постоянном давлении) |
 | Это изотермический процесс (протекающий при постоянной температуре) | |
 | — | Это квазиадиабатические процессы, протекающие, например, в двигателях внутреннего сгорания во время расширения газа |
 | — | 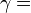  —- это показатель адиабаты, используемый при описании адиабатического процесса (происходит без теплообмена газа с окружающей средой) —- это показатель адиабаты, используемый при описании адиабатического процесса (происходит без теплообмена газа с окружающей средой) |
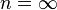 | — | Это изохорный процесс (протекающий при постоянном объёме) |
Когда показатель n лежит в пределах между любыми двумя значениями из указанных выше (0, 1, γ, или ∞), то это означает, что график политропного процесса заключён между графиками соответствующих двух процессов.
Заметим, что  , так как
, так как  .
.
Важной характеристикой термодинамической системы является ее внутренняя энергия. Как известно, энергия тела состоит из кинетической энергии движения тела со скоростью v и потенциальной энергии тела во внешних силовых полях (гравитационном, магнитном и т. д.):
Eмех=(1/2)·mv2+Eпот.
Согласно МКТ, все тела состоят из молекул, которые находятся в состоянии непрерывного, хаотического движения, то есть обладают кинетической энергией, а вследствие взаимодействия между собой обладают потенциальной энергией взаимодействия.
Внутренняя энергия – суммарная энергия хаотического (теплового) движения микрочастиц системы и энергия взаимодействия этих частиц.
Внутренняя энергия - однозначная функция термодинамического состояния системы (при переходе системы из одного состояния в другое изменение внутренней энергии определяется разностью значений внутренней энергии этих состояний и не зависит от пути перехода).
Как известно из механики, движение тел (или материальных точек) происходит в пространстве и во времени. Любое движение тела можно представить как комбинацию поступательного и вращательного движений. Положение тела в каждый момент времени характеризуется числом степеней свободы.
Число степеней свободы молекулы – число независимых переменных (координат), полностью определяющих положение системы в пространстве.
Молекулу одноатомного газа (в виду ее малости) можно рассматривать как материальную точку, которой приписывают три степени свободы поступательного движения: i=iпост (рис. 8).
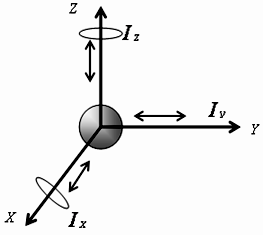
Рис. 8. К определению числа степеней свободы для одноатомной молекулы
Средняя кинетическая энергия поступательного движения одноатомной молекулы идеального газа равна:
E0=m0{vкв}2/2=3kT/2.
Вращательные степени свободы в данном случае не учитываются, так как момент инерции данной молекулы относительно каждой из осей: Ix=mr2, Iy=mr2, Iz=mr2, расстояние до осей вращения r→0, следовательно Ix→0, Iy→0, Iz→0, тогда кинетическая энергия вращения для каждой из осей:
Eк.вр.=Iω2→0.
Молекула двухатомного газа рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 9). Кроме трех поступательных степеней свободы, у такой молекулы появляются две вращательные степени свободы:
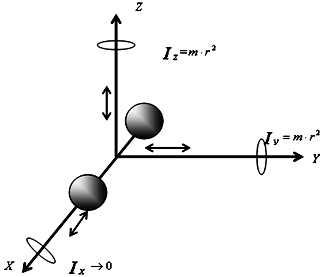
Рис. 9. К определению числа степеней свободы для двухатомной молекулы
i=iпост+iвращ=5
Трехатомная и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных (рис. 10):

Рис. 10. К определению количества степеней свободы для трехатомной молекулы
i=iпост+iвращ=6
На самом деле, жесткой связи между атомами не существует. Атомы в молекуле могут сближаться и расходиться, то есть могут совершать колебания около положения равновесия. Энергия колебательного движения молекулы является суммой кинетической и потенциальной энергий, средние значения которых одинаковы. Таким образом, для реальных молекул необходимо учитывать также степени свободы колебательного движения.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы – в среднем энергия, равная. Средняя энергия молекулы равна:
{ε}=[i/2]·kT, (46)
где i=iпост+iвращ+2iколеб
Установлено, что однако энергия поступательного и вращательного движений молекулы значительно меньше энергии колебательного движения атомов в молекуле, поэтому колебательные степени свободы возбуждаются при высоких температурах.
Внутренняя энергия идеального газа складывается только из кинетических энергий всех молекул в данном объеме, так как потенциальной энергией взаимодействия молекул, согласно допущениям модели идеального газа (п.1.3), можно пренебречь.
Для одного моля идеального газа:
Um=ENA=[i/2]·kNAT
Внутренняя энергия для произвольной массы идеального газа:
U=Umυ=[i/2]·mRT/M
 2017-12-14
2017-12-14 1344
1344