В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 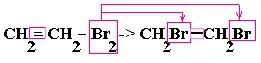 2. Изменение окраски раствора перманганата калия: 3СH2=CH2 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH 2. Изменение окраски раствора перманганата калия: 3СH2=CH2 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH 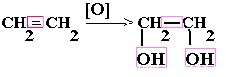 |
| Циклоалканы | Обесцвечивание бромной воды: 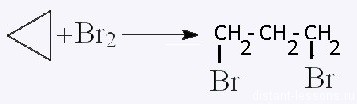 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди: 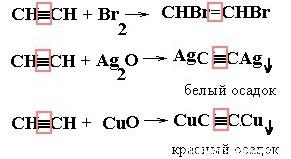 3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH 3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 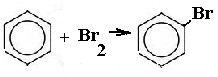 2.реакция с аммиачным раствором цианида никеля (II).Выпадает осадок комплексного соединения бензоцианоаммината никеля Ni(CN)2NH3(C6H6). 2.реакция с аммиачным раствором цианида никеля (II).Выпадает осадок комплексного соединения бензоцианоаммината никеля Ni(CN)2NH3(C6H6). |
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 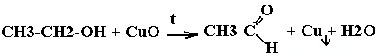 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 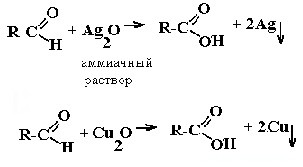 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Таблица качественных реакций для газов
| Описание | Формула | Реакции |
| Бурый газ | NO2 | 1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц | H2S | Взаимодействие активных металлов с концентрированной серной кислотой: 4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O |
| Газ с резким запахом. Растворимый в воде | SO2 | 1) взаимодействие серасодежащих веществ с кислородом 2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде | NH3 | 1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый | N2 | 1) горение азотсодержащих веществ; 2) разложение нитрита аммония: NH4NO2 = N2 + 2H2O |
| Газы, поддерживающие горение: (иногда, для озона — запах свежести); (для NO2 – бурый цвет) | O2 O3 NO2 | 3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
| желто-зеленое | фиолетовое | кирпично-красное | ярко-красное | желтое | карминово-красное |
| Ba2+ | K+ | Са2+ | Li+ | Na+ | Sr2+ |
Таблица качественных реакций
— цвета осадков
| Осадки белого цвета | Качественная реакция |
| Белый творожистый нерастворимый в воде; нерастворимый в HNO3 | Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
| Белый осадок нерастворимый в кислотах | Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
| Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах | Сa(OH)2 + SO2 = CaSO3↓ + H2O · избыток SO2: CaSO3↓ + H2O + SO2 = Ca(HSO3)2; · растворение в кислотах: CaSO3 + 2H+ → SO2↑ + H2O + Ca2+ |
| Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи | Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓ · избытокщелочи: Al(OH)3 + NaOH =Na[Al(OH)]4; · избытокщелочи: Zn(OH)2 +2NaOH =Na2[Zn(OH)]4; |
| Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах | Сa(OH)2 + CO2 = CaCO3↓ + H2O · избыток CO2: CaCO3↓ + H2O + CO2 = Ca(HSO3)2; · растворение в кислотах: CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
| Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; | Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
| Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; | Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
| Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; | 3Ag+ + PO43- → Ag3PO4↓ |
| Осадки коричневых цветов | Качественная реакция |
| Осадок бурого цвета образуется при взаимодействии с растворами щелочей; | Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
| Осадки синих цветов | Качественная реакция |
| Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей | Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
| Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли | 3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]4-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
| Осадки черного цвета | Качественнаяреакция |
| Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S | Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
 2017-12-14
2017-12-14 2759
2759