Нормальная скорость распространения пламени - скорость перемещения фронта пламени относительно несгоревшего газа в направлении, перпендикулярном к его поверхности.
Значение нормальной скорости распространения пламени следует применять в расчетах скорости нарастания давления взрыва газо- и паровоздушных смесей в закрытом, негерметичном оборудовании и помещениях, критического (гасящего) диаметра при разработке и создании огнепреградителей, площади легко сбрасываемых конструкций, предохранительных мембран и других разгерметизирующих устройств; при разработке мероприятий по обеспечению пожаровзрывобезопасности технологических процессов в соответствии с требованиями ГОСТ 12.1.004 и ГОСТ 12.1.010.
Сущность метода определения нормальной скорости.распространения пламени заключается в приготовлении горючей смеси известного состава внутри реакционного сосуда, зажигании смеси в центре точечным источником, регистрации изменения во времени давления в сосуде и обработке экспериментальной зависимости “давление-время” с использованием математической модели процесса горения газа в замкнутом сосуде и процедуры оптимизации. Математическая модель позволяет получить расчетную зависимость “давление-время”, оптимизация которой по аналогичной экспериментальной зависимости дает в результате изменение нормальной скорости в процессе развития взрыва для конкретного испытания.
Нормальной скоростью горения называют скорость распространения фронта пламени по отношению к несгоревшим реагентам. Скорость горения зависит от ряда физико-химических свойств реагентов, в частности теплопроводности и скорости химической реакции, и имеет вполне определенное значение для каждого горючего (при постоянных условиях горения). В табл. 1 приведены скорости горения (и пределы воспламенения) некоторых газообразных смесей. Концентрации горючего в смесях определены при 25°С и нормальном атмосферном давлении. Пределы воспламенения за отмеченными исключениями получены при распространении пламени в трубе диаметром 0,05 м, закрытой с обеих сторон. Коэффициенты избытка горючего определены как отношение объемных содержаний горючего в реальной смеси к стехиометрической смеси (j1) и к смеси при максимальной скорости горения (j2).
Таблица 1
Скорости горения конденсированных смесей (неорганический окислитель + магний)
| Окислитель | Стехиометрическая смесь | Богатая горючим смесь | ||||||||||||
| [Mg], % (масс.) | u • 102, м/с | и *, кг/(м2•с) | [Mg], % (масс.) | u max•102, м/с | и *, кг/(м2•с) | |||||||||
| LiNO3 | 46,8 | 1,87 | 83,3 | 2,96 | ||||||||||
| NaNO3 |
| 1,60 | 28,8 | 74,9 | 2,48 | 39,4 | ||||||||
| KNO3 | 37,6 | 0,74 | 12,5 | 75,5 | 1,30 | 20,0 | ||||||||
| Ca(NO3)2 | 42,6 | 0,46 | 73,1 | 1,00 | ||||||||||
| Ba(NO3)2 | 31,8 | 0,34 | 62,8 | 0,74 | ||||||||||
| Sr(NO3)2 | 36,5 | 0,32 | 6,4 | 65,4 | 0,72 | 12,3 | ||||||||
| Pb(NO3)2 | 26,8 | 0,26 | 60,2 | 0,70 | ||||||||||
| NaClO4 | 44,3 | 0,24 | 78,0 | 0,96 | ||||||||||
| КСlO4 | 41,3 | 0,23 | 4,2 | 77,1 | 0,68 | 10,9 | ||||||||
| NH4ClO4 | 29,2 | 0,22 | 3,6 | 79,3 | 0,42 | 6,5 |
Как видно, при горении воздушных газовых смесей при атмоферном давлении u mах лежит в пределах 0,40-0,55 м/с, а  – в пределах 0,3-0,6 кг/(м2-с). Лишь для некоторых низкомолкулярных непредельных соединений и водорода u mах лежит в пределах 0,8-3,0 м/с, а
– в пределах 0,3-0,6 кг/(м2-с). Лишь для некоторых низкомолкулярных непредельных соединений и водорода u mах лежит в пределах 0,8-3,0 м/с, а  достигает 1–2 кг/ (м2с). По увеличению и mах исследованные горючие в смесях с воздухом можно
достигает 1–2 кг/ (м2с). По увеличению и mах исследованные горючие в смесях с воздухом можно
расположить в следующий ряд: бензин и жидкие ракетные топлива – парафины и ароматические соединения – оксид углерода – циклогексан и циклопропан – этилен – оксид пропилена – оксид этилена – ацетилен – водород.
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| ТГиВ 20.05.01.070000.000 ПЗ |
Линейная скорость горения кислородных смесей значительно выше, чем воздушных (для водорода и оксида углерода – в 2-3 раза, а для метана – больше чем на порядок). Массовая скорость горения изученных кислородных смесей (кроме смеси СО + O2) лежит в пределах 3,7-11,6 кг/(м2•с).
В табл. 1 приведены (по данным Η. А. Силина и Д. И. Постовского) скорости горения уплотненных смесей нитратов и перхлоратов с магнием. Для приготовления смесей использовали порошкообразные компоненты с размерами частиц нитратов 150-250 мкм, перхлоратов 200-250 мкм и магния 75-105 мкм. Смесью заполняли картонные оболочки диаметром 24-46 мм до коэффициента уплотнения 0,86. Образцы сгорали на воздухе при нормальных давлении и начальной температуре.
Из сопоставления данных табл. 1 и 1.25 следует, что конденсированные смеси превосходят газовые смеси по массовой и уступают им по линейной скорости горения[1]. Скорость горения смесей с перхлоратами меньше скорости горения смесей с нитратами, а смеси с нитратами щелочных металлов горят с более высокой скоростью, чем смеси с нитратами щелочноземельных металлов.
Таблица 2
Пределы воспламенения и скорости горения смесей с воздухом (I) и кислородом (II) при нормальном давлении и комнатной температуре
| Горючее | Мольная доля горючего, a =1(I) | Пределы воспламенения (I) | j1(Ι) | u max (I), м/с |  |  | |||||||||||
| бедная смесь j1 | богатая смесь φ2 | I | II | I | II | ||||||||||||
| Водород | 0,2950 | -1,70 | 3,06 | 1,98 | 3,85 | 1,48 | |||||||||||
| Оксид углерода | 0,2950 | 0,34* | 6,76* | 1,70 | 0,45** | 0,51-0,62 | 1,25-1,35 | 0,37 | 1,35 | ||||||||
| Метан | 0,0917 | 0,46 | 6,40 |
| 0,39 | 0,35-0,52 | 3,7-5,1 | 0,38-0,45 | 4,15 | ||||||||
| Этан | 0,0564 | 0,50 | 2,72 | 1,12 | 0,46 | ||||||||||||
| Пропан | 0,0402 | 0,51 | 2,83 | 1,14 | 0,45 | 0,57 | 0,41 | ||||||||||
| Бутан | 0,0312 | 0,54 | 3,30 | 1,13 | 0,44 | 0,54 | |||||||||||
| н-Пентан | 0,0255 | 0,54 | 3,59 | 1,15 | 0,44 | ||||||||||||
| н-Гексан | 0,0216 | 0,51 | 4,00 | 1,17 | 0,45 | ||||||||||||
| н-Гептан | 0,0187 | 0,53 | 4,50 | 1,22 | 0,45 | ||||||||||||
| Циклопропан | 0,0444 | 0,58* | 2,76* | 1,13 | 0,55 | ||||||||||||
| Циклогексан | 0,0227 | 0,48 | 4,01 | 1,17 | 0,45 | ||||||||||||
| Этилен | 0,0652 | 0,41 | <6,1 | 1,15 | 0,79 | 0,88 | 0,72-0,89 | 7,61 6,45 | |||||||||
| Пропилен | 0,0444 | 0,48 | 2,72 | 1,14 | 0,50 | ||||||||||||
| Бутен-1 | 0,0337 | 0,53 | 3,53 | 1,16 | 0,50 | ||||||||||||
| Ацетилен | 0,0772 | 0,39* | 1,33 | 1,63 | 1,86 | 1,65-1,73 | 11,6 | ||||||||||
| Бутин-1 | 0,0366 | 1,20 | 0,67 | ||||||||||||||
| Бензол | 0,0271 | 0,43 | 3,36 | 1,08 | 0,47 | 0,61 | 4,6 | 0,6 | 4,6 | ||||||||
| Толуол | 0,0277 | 0,43 | 3,22 | 1,05 | 0,40 | ||||||||||||
| Гетралин C10H12 | 0,0158 | 1,01 | 0,38 | ||||||||||||||
| Оксид этилена | 0,0772 | 1,25 | 1,05 | 1,13 | 1,12 | ||||||||||||
| Оксид пропилена | 0,0497 |
| 1,28 | 0,81 | |||||||||||||
| Ацетон | 0,0497 | 0,59* | 2,33* | 1,31 | 0,49 | ||||||||||||
| Метанол | 0,1224 | 0,48 | 4,08 | 1,00 | 0,55 |
Методы расчета скорости выгорания жидкостей
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| ТГиВ 20.05.01.070000.000 ПЗ |
 ; (14)
; (14)
 ; (15)
; (15)
 ; (16)
; (16)
где M - безразмерная скорость выгорания;
 ; (17)
; (17)
MF - молекулярная масса жидкости, кг·моль-1;
d - характерный размер зеркала горящей жидкости, м. Определяется как корень квадратный из площади поверхности горения; если площадь горения имеет форму окружности, то характерный размер равен ее диаметру. При расчете скорости турбулентного горения можно принять d = 10 м;
Тк - температура кипения жидкости, К.
Порядок расчета следующий.
Определяют режим горения по величине критерия Галилея Ga, вычисляемого по формуле
 , (18)
, (18)
где g - ускорение свободного падения, м·с-2.
В зависимости от режима горения вычисляют безразмерную скорость выгорания М. Для ламинарного режима горения:
 ;
;  , (19)
, (19)
Для переходного режима горения:
если 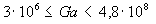 , то
, то  , (20)
, (20)
если  , то
, то 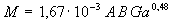 , (21)
, (21)
Для турбулентного режима горения:
 ;
;  , (22)
, (22)
где  ;
;  ;
;
M0 - молекулярная масса кислорода, кг·моль-1;
n0 - стехиометрический коэффициент кислорода в реакции горения;
nF - стехиометрический коэффициент жидкости в реакции горения.
B - безразмерный параметр, характеризующий интенсивность массопереноса, вычисляемый по формуле
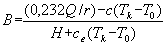 , (23)
, (23)
где Q - низшая теплота сгорания жидкости, кДж·кг-1;
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| ТГиВ 20.05.01.070000.000 ПЗ |
 - безразмерное значение массы кислорода, необходимого для сгорания 1 кг жидкости;
- безразмерное значение массы кислорода, необходимого для сгорания 1 кг жидкости; c - изобарная теплоемкость продуктов горения (принимается равной теплоемкости воздуха c = 1), кДж·кг-1·К-1;
T0 - температура окружающей среды, принимаемая равной 293 К;
H - теплота парообразования жидкости при температуре кипения, кДж·кг-1;
ce - средняя изобарная теплоемкость жидкости в интервале от T0 до Tк.
Если известны кинематическая вязкость пара или молекулярная масса и температура кипения исследуемой жидкости, то скорость турбулентного горения вычисляют с использованием экспериментальных данных по формуле

 , (24)
, (24)
где mi - экспериментальное значение скорости выгорания в переходном режиме горения, кг·м--2·с-1;
di - диаметр горелки, в которой получено значение mi, м. Рекомендуется использовать горелку диаметром 30 мм. Если в горелке диаметром 30 мм наблюдается ламинарный режим горения, следует применять горелку большего диаметра.
Относительная погрешность расчета по формулам (16) и (24) не превышает 21 %.
Если не известны кинематическая вязкость паров или молекулярная масса и температура кипения исследуемой жидкости, то оценку скорости выгорания проводят в следующем порядке.
Находят скорость выгорания жидкости в горелках диаметром 10, 15, 18, 20. 25 и 30 мм Полученные результаты заносят в табл. 3.
Вычисляют среднее арифметическое значение (md), л, для всех испытаний в которых наблюдалось ламинарное горение.
Таблица 3
| Диаметр горелки, di, м | Скорость выгорания  , кг·м-2·с-1 , кг·м-2·с-1 | Режим горения (визуальное наблюдение) | 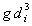 , м·с-2 , м·с-2 |  , кг·м-1·с-1 , кг·м-1·с-1 |
Результаты испытаний, относящиеся к переходному режиму горения, заносят в табл. 4 в виде функций  ,
,  ,
, 
 , с точностью до четвертого знака после запятой.
, с точностью до четвертого знака после запятой.
Количество экспериментальных точек должно быть не менее трех, в
противном случае проводят дополнительные эксперименты в горелках диаметром более 30 мм.
Таблица 4
| № п/п (i) | 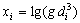 |  |  |  |
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| ТГиВ 20.05.01.070000.000 ПЗ |
 ,
, 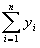 ,
,  ,
,  , и средние значения
, и средние значения  ,
,  ,
, где n - число экспериментальных точек, относящихся к переходному режиму горения.
Вычисляют параметры а и b по формулам:
 , (25)
, (25)
 . (26)
. (26)
Определяют кинематическую вязкость паров исследуемой жидкости () по формуле
 . (27)
. (27)
Скорость выгорания вычисляют по формуле (24).
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| ТГиВ 20.05.01.070000.000 ПЗ |
1.Расчет объема воздуха, необходимого для полного сгорания 1 кг горючего вещества:
а) Уравнение реакции горения

б) Определение массы 1 Кмоля горючего вещества
 кг
кг
в) Определение объема воздуха для горения 1 м3 ДТ при нормальных условиях:
 м3
м3
г) Определяем реальный расход воздуха с учетом заданных условий и избытка воздуха
 м3
м3
 2017-12-14
2017-12-14 5634
5634
