Ацетатты буферлі қоспа CH3COOH+CH3COONa CH3COOH (әлсіз қышқыл)
CH3COOH ↔ CH3COO- + H+
 Кқышқыл =
Кқышқыл =  (20)
(20)
(1) Теңдіктен сутегі иондарының концентрациясын табамыз:
 (21)
(21)
Әлсіз қышқылдар үшін [CH3COOH] = Cқышқыл және [CH3COO-] + [H+], бірақ әлсіз қышқылға бір аттас ион CH3COONa бар күшті электролит қосқанда кезде қышқылдың диссоциациясы күрт баяулайды, сонда (2) теңдікті мына түрде жазуға болады:
[H+] = 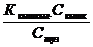 (3)
(3)
Теңдіктің екі бөлігінде логарифмдеу арқылы:
-Ig[H+] = pH = - IgKқышқыл – IgCқышқыл + IgCтұз (22)
аламыз. Ал - IgKқышқыл = рКқышқыл - Қышқыл көрсеткіш
рН = рКқышқыл -  (23)
(23)
Аммиакты буферлі қоспаны дәл осындай жолмен талдай отырып:
NH4OH ↔ NH4+ + OH-
Kнегіз =  ;
; 

pOH = pKнегіз -  , рН = 14 - рОН
, рН = 14 - рОН
рН = 14 - pKнегіз + Ig 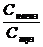
Буферлік ерітінділердің химиялық талдауда қолданылуы
1. Химиялық реакцияда рН- тың дәл мағынасын сақтап, кеңінен қолданылады
2. 3-ші аналитикалық топтың сульфидтері түрінде катиондарын тұнбаға түсіру үшін, рН –ы 9-9,2 болуы керек және барий, стронций, кальций иондарын бөлу үшін анализ жасалып жатқан ерітіндідегі ацетатты буферлі қоспасын қосамыз.
Буферлі қоспаны есептеп шығарудың мысалдары
тҰЗДАР ГИДРОЛИЗІ
12.1 Массалардың әрекеттесу заңын гидролиз реакцияларына қолдану
Ерімтал тұздарды суда ерітіп, индикаторлармен әсер етсек, бұл жағдайда да олардың түстерінің өзгеруі байқалады. Осыдан мынадай қорытынды шығаруға болады: тұз иондары су иондарының бірін байланыстырып, екіншісінің концентрациясы артуына байланысты индикатор түсін өзгертеді.
Тұздар гидролизі деп су иондары мен тұз иондарының химиялық әрекеті нәтижесінде әлсіз электролит ионы не молекуласы түзіле жүретін реакцияны айтады.
Тұздарды түзілу табиғатына байланысты төртке бөледі:
1) күшті негіз бен күшті қышқыл тұзы,
2) күшті негіз бен әлсіз қышқыл тұзы,
3) күшті қышқыл мен әлсіз негіз тұзы,
4) әлсіз қышқыл мен әлсіз негіз тұзы.
Енді осылардың әрқайсысына бір мысалдан келтіріп, тұздар гидролизін қарастырайық..
Күшті негіз, күшті қышқыл тұзы.
Na2SO4 – натрий сульфаты NaOH және H2SO4 әрекеттесуінен түзілген тұз. Тұздың және диссоциациялану теңдеуін жазайық:

Электростатика заңы бойынша қарама-қарсы зарядты иондар бір-бірін тартып, мынадай қосылыстар түзілуі тиіс: NaOH, H2SO4, ал бұл электролиттер күшті (α =1), сондықтан олар түзілген сәтте қайтадан иондарға ыдырап кетеді де, су иондарының концентрациясы еш өзгеріссіз қалады, олай болса, мұндай тұздар гидролизденбейді.
Күшті негіз (NaOH), әлсіз қышқыл (H2S) тұзының (Na2S) гидролизін қарастырайық.
Тұз бен су диссоциациясын жазайық:
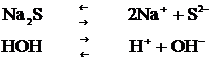
Бұл жағдайда тұз құрамындағы қышқыл қалдық ионы су құрамынан сутек иондарын қосып, әлсіз электролит (H2S) ионы H S- түзеді де, ерітіндіге OH- ионы босап шығады. Сонда, тұз гидролизденуінің (1)-сатысының иондық теңдеуі:

Сөйтіп, су иондары концентрациясының өзгерісінен орта негіздік (pH>7). Гидролиз қайтымды үрдіс. Олай болса, тепе-теңдік константасы:

Енді осы теңдіктің алымы мен бөлімін сутек иондары концентрациясына көбейтсек:
 (24)
(24)


Тұздың гидролизденуінің молекулалық теңдеуі:

Реакция нәтижесінде түзілген қышқыл тұз ары қарай гидролизге ұшырауы мүмкін, енді соны қарастырайық:

 рН>7
рН>7
Реакцияның молекулалық теңдеуі:


Енді осы тұздың екі сатысының гидролизденуін өзара салыстырсақ: Кг(1) > Кг(2), олай болса, тұздардың гидролиздену үрдісінің алғашқы сатысы соңғыларынан оңай жүреді.
Қорыта келе, күшті негіз әлсіз қышқыл тұзы гидролизденгенде тұз құрамындағы қышқыл қалдық анионы су құрамындағы сутек ионымен әлсіз электролит ионы немесе молекуласын түзіп, ерітіндіге гидроксил иондары босап шығады, демек мұндай тұздардың судағы ерітіндісінің ортасы негіздік болады (pH>7).
Күшті қышқыл әлсіз негіз тұзының гидролизі.
Аммоний хлоридінің гидролизін қарастырайық, ол әлсіз NH4OH, күшті HCl әрекеттесуінен түзіледі.


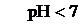

Бұл бөлшектің алымы мен бөлімін гидроксил иондары концентрациясына көбейтсек:
 (25)
(25)

Гидролизденудің молекулалық теңдеуі:
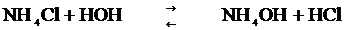
Сонда, күшті қышқыл мен әлсіз негіз тұзы гидролизденгенде негіз құрамындағы катион су құрамынан гидроксил ионын қосып алып, ерітіндіге сутек иондары бөлініп шығуына байланысты орта қышқылдық (pH<7) болады. Егер әлсіз негіз көп қышқылды болса, яғни оның құрамында бірнеше гидроксил ионы болса, оның тұздары сол топтар санымен бірдей сатымен гидролизденеді, әрине мұнда да алғашқы сатысының гидролизденуі соңғы сатылармен салыстырғанда оңайырақ жүреді, яғни Кг(1) > Кг(2) > Кг(3) т.т.
Әлсіз негіз әлсіз қышқыл тұзының гидролизі.
Аммоний ацетатының (NH4Ac) гидролизін қарастырайық, бұл тұз әлсіз аммоний гидроксиді (NH4OH) әлсіз сірке қышқылының (CH3COOH) әрекеттесуінен түзіледі.
Мұндай тұздарды суда еріткенде толық гидролизденеді, себебі су иондарын тұз құрамындағы екі ионды қосып алып, әлсіз электролиттер түзеді.

Оны былай жазуға болады:

 (26)
(26)
Ал, осындай тұздардың ортасы не әлсіз негіздік, не әлсіз қышқылдық болады, ол тұз түзішу электролиттердің диссоциациялану константаларының мәндеріне байланысты болады. Біздің қарастырылған мысалымыздағы тұз ерітіндісінің ортасы бейтарап болады, өйткені
КД(NH4OH) = КД(HAc) = 10-5
Гидролиздену үрдісін гидролиздену константасынан басқа гидролиздену дәрежесі (Һ) сипаттайды. Тұздардың гидролиздену дәрежесі заттардың диссоциациялану дәрежесі (α) сияқты гидролизденген мольдер санының жалпы суға еріткен тұздың моль санына қатынасымен анықталады:
 (27)
(27)
Қорыта келе, бейтараптану реакциясына төмендегідей анықтама берген жөн: бейтараптану реакциясы деп күшті қышқыл мен күшті негіз арасындағы алмасу реакциясы. Басқа жағдайларда қышқыл мен негіз әрекеттесуінен түзілген тұздар толық немесе жартылай гидролизденіп кетеді.
Кесте -17 Тұздардың диссоциациялану дәрежесі мен тұздардың гидролиздену дәрежесінің формулаларындағы ұқсастық
| α,h № | α-диссоциациялану дәрежесі | h-гидролиздену дәрежесі |
| Кд=α2С | Кг=h2С | |
α=  | h=  | |
| СI(ион)=С(зат)α· n | CI(ион)=C(тұз)h· n |
Кесте -18 Тұздар гидролизін сипаттайтын сандық шамалар формулалары
| Тұздар шамалар | Күшті қышқыл, әлсіз негіз тұздары | Әлсіз қышқыл, әлсіз негіз тұзы | Күшті негіз, әлсіз қышқыл |
| КГ |  |  |  |
| Һ |  |  |  |
| CI(H+) |  |  |  |
| pH |  |  |  |
12.2 Тұздардың гидролизін күшейту және әлсірету
Көп жағдайларда гидролиз құбылысы талдауға кедергі жасайды, сол үшін гидролизді күшейту,не әлсірету керек.
12.3 Гидролизді химиялық талдауда қолдану
12.4Гидроксидтердің амфотерлігі
АНАЛИТИКАЛЫҚ ХИМИЯДАҒЫ ТОТЫҒУ-ТОТЫҚСЫЗДАНУ ҮРДІСТЕРІ
Тотығу – тотықсыздану реакциясы
Химиялық реакцияларға қатысатын заттар құрамындағы элементтердің тотығу дәрежесін өзгерте жүретінін тотығу–тотықсыздану реакциялары (ТТР) деп атайды.
Элементтің валенттілігі мен тотығу дәрежелері туралы түсінік және оларды атом құрылысы бойынша анықтау туралы «Атом құрылысы» тарауында қарастырылған. Тотығу дәрежесінің валенттіліктен өзгешелігі оң және теріс мәнді, бүтін және бөлшек сандарды да қабылдайды. Элементтің қосылыстағы валенттілігі мен тотығу дәрежесінің модулі тең болуы да, болмауы да мүмкін. Осы айтқандарды түсіну үшін азоттың сутекті қосылыстарын қарастырып көрейік.
Кесте 19 Азоттың сутекті қосылыстарындағы валенттіліктері мен тотығу дәрежелері.
| Молекулалық формуласы | NH3 аммиак | N2H4 гидразин | NH2OH гидроксиламин | HN3 азотты сутек қышқылы |
| Графикалық формуласы | H→N←H ↑ H | H H ↓ ↓ N – N ↑ ↑ H H | H ↓ N→O ←H ↑ H | H→N═N≡N |
| Валенттілік (N) | III | III | III | III, V |
| Тотығу дәрежесі (N) | -3 | -2 | -1 | -1/3 |
Элементтің тотығу дәрежесін анықтау үшін мыналарды білген жөн:
1) ионды байланысты қосылыстарда элементтердің тотығу дәрежелері иондар зарядтарына тең болады. (Na+Cl- т.д.(Na)=+1; т.д.(Cl)=-1);
2) ковалентті полюссіз байланысты қосылыстарда (жай зат молекулаларында:  ) нольге тең болады;
) нольге тең болады;
3) сутектің тотығу дәрежесі металдар гидридтерінен басқа қосылыстарында үнемі +1-ге тең, ал металдар гидридтерінде -1-ге тең;
4) оттектің тотығу дәрежесі көп жағдайда -2-ге тең, тек мынандай қосылыстарында ғана өзгеше  ;
;
5) ковалентті полюсті байланысты қосылыстарда ( ) элементтердің тотығу дәрежелері ығысқан электрондар сандарымен анықталады;
) элементтердің тотығу дәрежелері ығысқан электрондар сандарымен анықталады;
6) қосылыс құрамына кіретін элемент атомдарының тотығу дәрежелерінің алгебралық қосындысы нольге тең болады, ( +1·2+4·1+3·(-2)=0) себебі молекулада заряд болмайды.
+1·2+4·1+3·(-2)=0) себебі молекулада заряд болмайды.
Томск технологиялық институтының мұғалімі орыстың ұлы ғалымы С.В. Даин тотығу–тотықсыздану реакциясы туралы алғашқы түсініктерді ретке келтіріп, бұл реакциялардың ерекшеліктерін есепке ала отырып, тотығу–тотықсыздану реакциясын түсіндіру үшін нұсқау жасады. Тотығу–тотықсыздану реакциясы теңдігіне қойылатын коэффициенттерді қалай таңдап алу керектігін теория жүзінде негіздеп, практика жүзінде дәлелдеді.
С.В. Даин еңбектерін жазуда Дж. Томсон және У. Рамзай еңбектері (атомда электрондардың болуы) алғы шарт болды. Электрондар атом ішінде ғана қозғалып қоймай, бір элемент атомынан екіншісіне ауысу мүмкіндігін және ауысатын электрондар саны туралы да өз қорытындыларын жасады. 1913ж. 4–желтоқсанда Киевтегі физико-химиялық қоғамның отырысында тотығу-тотықсыздану реакциясы туралы тұжырымын қорытындылап жариялады.
Тотығу–тотықсыздану реакциясының теориясын жалғастырушы Писаржевский Л.В. болды.
Химиялық реакцияларда электрондарын беретін атомдарды, иондарды, молекулаларды тотықсыздандырғыштар деп, ал үрдісті тотығу деп атайды.
Химиялық реакцияларда электрондарды қосып алатын атомдарды, иондарды, молекулаларды тотықтырғыштар, ал үрдісті тотықсыздану деп атайды.
Тотықтырғыштар (Ох – oxydation) электрондарды қосып тотықсызданады (Red – reduction – тотықсыздану), сонда оның оң тотығу дәрежесі кеміп, теріс тотығу дәрежесінің шамасы (модулі бойынша) артады.
Ox +  = Red
= Red
Ал, тотықсыздандырғыштар электронды беріп, оның теріс тотығу дәрежесі модулі бойынша кеміп, оң тотығу дәрежесі артады.

Енді осыны түсіну үшін күкірт элементінің валенттілік электрондарының формуласын жазып, қосылыстарындағы мүмкін болатын валенттіліктері мен тотығу дәрежелерін анықтап, олардың өзгерістерін қарастырайық.
 валенттілік электрондарының формуласы: 3s23p43d0. Валенттілік электрондарының электронды-графикалық формуласы:
валенттілік электрондарының формуласы: 3s23p43d0. Валенттілік электрондарының электронды-графикалық формуласы:





|
 |




|



|
Валенттіліктері: ІІ, IV, VI.
Тотығу дәрежелері: -2 0 +2 +4 +6
Электрондық теңдеу жазғанда сан осін пайдаланған жөн:
 |














 -2 0 +2 +4 +6
-2 0 +2 +4 +6




Олай болса, күкіртті сутек қышқылы (H2S) және оның тұздары тотығу–тотықсыздану реакцияларында тек тотықсыздандырғыштар болса, күкірт қышқылы (H2SO4) және SO3 тек тотықтырғыш, ал күкіртті қышқыл (H2SO3) және оның тұздары әрі тотықтырғыш, әрі тотықсыздандырғыш болатыны көрініп тұр.
Элементтің тотығу–тотықсыздану қасиеттері төмендегі факторларға тәуелді:
1) элемент табиғатына (электрон құрылысына),
2) элементтің атом, ион радиустарына,
3) элементтің тотығу дәрежелеріне.
Кесте - 20 VIA, VIIA топтары элементтері мен қосылыстарының тотығу-тотықсыздану қасиеттері
| элемент | валенттілік электронның формуласы | атом радиусы | элемент | валенттілік электронның формуласы | тотықтырғыш қасиеті | сутекті қосылыс-тары | Тотықсыз-дандырғыш қасиеті | |
| O | 2s22p4 |  артады артады | F | 2s22p5 |  артады артады | H2O | HF |  артады артады |
| S | 3s23p4 | Cl | 3s23p5 | H2S | HCl | |||
| Se | 4s24p4 | Br | 4s24p5 | H2Se | HBr | |||
| Te | 5s25p4 | J | 5s25p5 | H2Te | HJ |
Тотықсыздандырғыштар бола алатындар:
а) барлық элементтердің бейтарап атомдары (фтор мен инертті газдардан басқа);
ә) барлық бейметалдардың теріс тотығу дәрежесіндегі күйіне сәйкес қосылыстары;
б) элементтердің аралық тотығу дәрежелеріне сәйкес келетін қосылыстары.
Тотықтырғыш болатындар:
а) электрон тартқыштығы мен электртерістіліктері басым бейметалл атомдары,
ә) элементтердің аралық тотығу дәрежелеріне сәйкес келетін қосылыстары,
б) жоғары тотығу дәрежелеріне сай келетін элемент қосылыстары.
Тотығу–тотықсыздану реакциясы бойынша бөлшектің (молекула, атом, ион) эквиваленттік факторын анықтауға болады, ол осы үрдісте бір электрондықосып немесе бере алатын зат мөлшері болып саналады.
Мысалы: 
 , олай болса f (KMnO4) = 1/5 моль
, олай болса f (KMnO4) = 1/5 моль
mэ (KMnO4) = M· fэ = M/5 = 158/5 = 31,6 г.
Тотығу–тотықсыздану реакциясының үш типі бар:
молекула аралық, молекула ішілік, өзіндік немесе диспропорциялану реакциялары.
1) Молекула аралық тотығу–тотықсыздану реакцияларында әрекеттесуші заттардың бірі тотықтырғыш болса, екіншісі – тотықсыздандырғыш болады.
Мысалы, 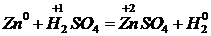
 тотықсыздандырғыш – тотығу
тотықсыздандырғыш – тотығу
 тотықтырғыш - тотықсыздану
тотықтырғыш - тотықсыздану
2) Молекула ішілік тотығу–тотықсыздану реакциясы деп реакция нәтижесінде бір молекула ішіндегі екі элемент атомының тотығу дәрежесі өзгере жүретін реакцияны айтады.



4) Өзіндік тотығу–тотықсыздау немесе диспропорциялану реакциясы деп, реакцияға қатысатын молекула құрамындағы бір элемент тотығу дәрежесін екі түрлі өзгерте жүретін реакцияны айтады.


Тотығу-тотықсыздану реакциясын теңестіру тәсілдері
Тотығу–тотықсыздану реакциясының теңдігін теңестірудің екі әдісі бар: электрондық баланс және ионды-электронды баланс.
Екі тәсіл бойынша реакция теңдіктерін теңестіру үшін тотықтырғыштың қосатын, тотықсыздандырғыштың беретін электрондар сандарын теңестіру арқылы жүргізіледі.
Тотығу-тотықсыздану реакциясы теңдеуін теңестірудің электрондық-баланс тәсілі
| № | Іс-әрекет кезегі | Мысалы |
| Реакцияға қатысқан әрі түзілген заттардың формулалары жазылады |  | |
| Қосылыс құрамындағы элементтердің тотығу дәрежелерін анықтап, элемент таңбасы үстіне жазамыз |  | |
| Тотығу дәрежелерін өзгерткен элемент атомдарының астын сызып, теңдеудің астына сол өзгерістердің сұлбасын жазамыз |    | |
| Тотығу-тотықсыздану жұптары үшін электрон айырымын анықтаймыз | 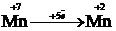  | |
| Реакция кезінде берген және қосып алған электрондар сандарын теңестіретін коэффициенттерді табамыз |   | |
| Тотықтырғыш пен тотықсыздандырғышты, тотығу мен тотықсыздану процесін анықтаймыз |     | |
| Табылған коэффициенттерді теңдеудегі зат формулалары алдына қоямыз (реакцияға қатысқан HCI – тек тотықсыздандырғыш болып қана қоймай, әрі тұз түзу үшін жұмсалғандықтан, коэффициентті теңдіктің оң жағына қоюдан бастаймыз) |  | |
| Теңдіктің оң және сол жағындағы атомдар санын салыстыру арқылы белгісіз коэффициенттерді анықтап, стрелка орнына теңдік белгісі қойылады |  |
Ионды-электронды баланс тәсілі бойынша реакцияның жүретін ортасы (рН) еске алынып, реакцияға қатысатын заттар құрамындағы иондардан басқа су молекуласы мен иондары қатысатындығы ескеріліп, «Байланыстыру» ережесі негізінде реакцияның ионды-электронды теңдеуі құрылады.
Кесте - 22 Ионды-электрондық тәсіл бойынша тотығу-тотықсыздану реакциясы теңдеуін теңестіру
| № | Іс-әрекет кезегі | Мысалы |
| Реакция теңдігінің сұлбасын жазып, заттардың сулы ортада қандай күйде (диссоциацияланбаған молекула, ион, суда нашар еритін зат) болатынын анықтау |  | |
| Тотықтырғыш пен тотықсыздандырғыштар үшін «байланыстыру» ережесін пайдаланып иондық теңдеулерін құру |  | |
| Иондық теңдеудің оң және сол жағындағы иондар заряды бойынша процеске қатысқан электрондар санын анықтау | 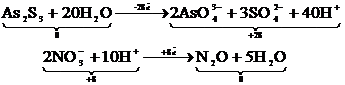 | |
| Процестерге қатысатын электрондар балансын құрып, коэффициенттерін анықтау |    | |
| Коэффициенттерін қойып, ионды-электронды теңдеудің оң жағын оң жағына, сол жағын сол жағына қосып жазу |  | |
| Теңдіктің екі жағындағы бірдей бөлшектерді (иондарды, молекулаларды) теңдіктен шығару |   | |
| Теңдіктің екі жағына да қарама-қарсы зарядты иондарды жазу (қышқылдық ортада – сутек иондарын, ал басқа орталарда – металл катиондарын) |  | |
| Тотығу-тотықсыздану реакциясының молекулалық теңдеуін құру |  |
«Байланыстыру» ережесі
| Тотығу-тотықсыздану реакциясындағы рөлі | рН | Механизмі | Мысалы |
Тотықтырғышта  атомы артық болса атомы артық болса |  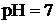  |  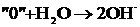 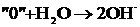 |    |
Тотықсыздандыр-ғышта  атомы жетпесе атомы жетпесе |  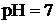  |    | 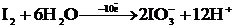   |
Осы ионды-электронды баланс тәсілін пайдаланудың артықшылықтары:
1) реакцияға қатысатын және түзілген заттар құрамындағы элемент атомдарының тотығу дәрежелерін табудың қажеттілігі болмайды;
2) тотығу–тотықсыздану реакциясының қысқартылған иондық теңдеуі құрылады;
3) осы тотығу–тотықсыздану үрдісіне реакция ортасының әсері бірден байқалады;
Ал, бұл тәсілдің бір кемшілігі, оны тек сулы ортада жүретін реакциялар үшін пайдалануға болады, ал электрондық баланс тәсілі бұл тәсілге қарағанда әмбебап болып табылады.
Тотығу–тотықсыздану реакциясы нәтижесінде түзілетін өнім: а) ерітінді ортасына; ә) әрекеттесетін заттың концентрациясына; б) заттардың табиғатына тәуелді.
а) перманганат және бихромат иондарының әр түрлі ортада тотықсыздануы:
 | рН < 7 | 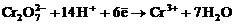 |
 | pH > 7 |  |
 | pH = 7 |  |
ә) азот қышқылының концентрациясы әр түрлі болған кезде тотықсыздануын қарастырайық:
Cu+2HNO3(конц.) = Cu(NO3)2+NO2↑+H2O
3Cu+8HNO3(сұйық) = 3Cu(NO3)2+2NO↑+4H2O
4Mg+10HNO3(өте сұйық) = 4Mg(NO3)2+NH4NO3+3H2O
б) аммоний тұздарының термиялық ыдырауын қарастырсақ:

Бұл мысалдан аммоний тұздарының қыздырғанда айырылатыны және реакция нәтижесіндегі өнімнің әр түрлі болуы қышқыл қалдықтарындағы азоттың тотығу дәрежесіне (тотықтыру қабілетіне) тәуелділігі көрініп тұр.
Осыған байланысты тағы да бір мысал келтіруге болады:

Бұл реакциядан шыққан өнім галогенид иондарының тотықсыздандырғыш қасиеттерінің әр түрлілігіне байланысты (иодты сутектің тотықсыздандырғыштың қасиеті қалған галогенді сутектерге қарағанда басым).
Гальвани элементі
Металдар химиялық реакцияларда тотықсыздандырғыштар болады, олар тотықтырғыштарға электрондарын береді, осы қабілет барлық металда бірдей болмайды. Металдардың салыстырмалы химиялық белсенділігін зерттеп, Н.Н.Бекетов олардың химиялық белсенділік қатарын ұсынады, бұл қатарды ығыстыру және кернеу қатары деп те атайды.
Осы қатар металдардың реакцияларда қандай химиялық өзгерістерге ұшырайтындығын көрсетеді:
1) әрбір металл өзінен кейін орналасқандарын олардың тұздарынан ығыстыра алады, ал оның өзін алдында тұрған металдың кез келгені ығыстырады,
2) сутекті оның алдында тұрған металдар қышқылдарының (сұйытылған H2SO4 және тотықсыздандырғыш қышқылдар) ерітіндісінен ығыстырып шығарады,
3) қатар тұрған екі элементтің қайсысы сол жағында орналасса, сол активтірек.
Металдардың салыстырмалы химиялық белсенділігін орын басу реакциясын жүргізу арқылы көз жеткізуге болады.

Ал, енді осы реакция кері бағытта жүре ала ма деген сұрақ туады. Оған жауап беру үшін таза суға батырылған осы металдар тіліктерін қарастырайық. Кристалдық торының түйіндерінде металл атомдары және иондары орналасқан, судың полюсті молекулаларының әсерінен ол иондар ерітіндіге көшеді.

Сөйтіп, металдың бетінде қос электрлі қабат пайда болады, осы қос электрлі қабатта туатын потенциал айырымын металдың электродтықпотенциалы деп атайды, бірақ оның абсолюттік мәнін өлшеу мүмкін емес, сондықтан практикада салыстырмалы потенциалды пайдаланады. Ол үшін стандартты сутек электродын қолданады, оның потенциалын стандартты жағдайда нольге тең деп есептейді 
Потенциалдарды салыстыруға арналған сутек электроды сутек иондарының концентрациясы 1 моль/л болып келетін H2SO4 ерітіндісіне батырылған беті ұсақ платина түйіршіктерімен кеуектеу етіп қапталған платина тілігінен тұрады. Осы ерітіндіге таза сутегі газы үзбей жіберіліп тұрады, сонда осы газ платина бетіне сіңіп, платина электроды сутектен жасалғандай болады, оның бетінде мынандай тепе-теңдік орнайды:
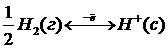

Сурет 9.1. Сутектік электрод
Кез келген металдың салыстырмалы потенциалын анықтау үшін сол металдан жасалған электродты (с(Men+)=1 моль/л) сутек электродымен байланыстырғанда химиялық белсенділігі жоғары металдардан электрон сутек электродына қарай қозғалғандықтан потенциалы теріс таңбалы болады  . Ал химиялық белсенділігі төмен металдарға сутектік электродтан электрон қозғалады, сондықтан олардың потенциалы оң таңбалы
. Ал химиялық белсенділігі төмен металдарға сутектік электродтан электрон қозғалады, сондықтан олардың потенциалы оң таңбалы  болады. Металдардың химиялық белсенділік қатары осыған байланысты кернеу қатары деп аталады.
болады. Металдардың химиялық белсенділік қатары осыған байланысты кернеу қатары деп аталады.
Металдардың электрохимиялық қатарында берілген электродтық потенциал мәндері стандартты жағдайдағы беріледі. Сондай стандартты электродтық потенциал деп осы жағдайдағы стандартты сутектік электродпен салыстырғандағы мәндерін айтады.
Кесте -24 Металдардың электрохимиялық кернеу қатары

1) Жоғарыда келтірілген орын басу реакциясын былай да жүргізуге болады: мырыш және мыс электродтарынан жұп құрып, сыртқы және ішкі тізбекті тұйықтасақ мынандай үрдіс жүзеге асады:


Сурет 9.2. Даниэль-Якоби элементі
Сыртқы тізбектен тотығу–тотықсыздану үрдісінің электрондары қозғалса, ішкі тізбектен иондар қозғалып, тізбек тұйықталып, ток пайда болады. Осы негізде жұмыс істейтін химиялық энергияны электр энергиясына айналдыратын қондырғыны гальвани элементі деп атайды, оның аты 18-ғасырда өмір сүрген итальян ғалымы Л.Гальвани құрметіне қойылған.
Бетінде тотықсыздану үрдісі жүретін мыс электроды катод (К) деп, тотығу үрдісі жүретін мырыш электроды анод (А) деп аталады, сонда, жоғарыда келтірілген суреттегіні былай жазуға болады:
Анод (–) Zn/Zn2+ || Cu2+/Cu (+) Катод. (Даниэль-Якоби элементі).
Гальвани элементі деп тотығу–тотықсыздану реакциясының энергиясын электр энергиясына айналдыратын қондырғыны айтады.
Гальвани элементінің тудыратын электр тогінің шамасы жүйенің электр қозғаушы күшіне байланысты, оның сандық мәні тотықтырғыштың потенциалынан тотықсыздандырғыш потенциалының айырмасына тең болады.
Е = φт-т-ш – φт-с-ш (9.1)
Сонда, мырыш-мыс электродының Э.Қ.К стандартты жағдайда:
 =+0,34 В – (-0,76) = 1,1 В
=+0,34 В – (-0,76) = 1,1 В
Электродтың потенциалының сандық мәні металдың табиғатына (φо), ерітінді концентрациясына (с), температураға (Т) тәуелді. Бұл тәуелділік Нернст формуласымен өрнектеледі:
 (9.2)
(9.2)
 (9.3)
(9.3)
 (9.4)
(9.4)
мұндағы φ – электродтық потенциал
φо – стандартты электродтық потенциал
R – универсал газ тұрақтысы
Т – абсолюттік температура
n – элементар актідегі ауысатын электрон саны
Ғ – Фарадей саны
с – тотыққан және тотықсызданған күйлерінің концентрациясы
х,у – реакция теңдеулеріндегі коэффициенттер.
Гальвани элементі тек электр қозғаушы күшінің сандық мәні нольден үлкен болғанда ғана жұмыс істейді. Кернеу қатарындағы гальвани түзуші элемент орны бір-бірінен неғұрлым алшақ болса, соғұрлым электр қозғаушы күшінің мәні үлкен болады.
Тұздарының концентрациясы әр түрлі ерітіндіге бір түрлі электрод батырылса, оны концентрациялық тізбек деп атайды.

Концентрациялық гальвани элементінің сыртқы тізбектің теріс полюсін беретін электрод концентрациясы төмен ерітіндіге батырылған болса, концентрациясы жоғары ерітіндіге батырылғаны – оң полюсті болады. Сонда, анодтың еруіне байланысты 1-ерітіндідегі ион концентрациясы артып, ал 2-ерітіндідегісі – кемиді, себебі мынандай электрохимиялық үрдіс жүреді:

Концентрациялық элемент екі жарты элементтегі электролит концентрациялары теңескенде (φт-т-ш = φт-с-ш , Е=0), элемент жұмысын тоқтатады.
Гальвани элементінің 1-,2-түрлерінде электрод тотығу–тотықсыздану үрдісіне тікелей қатысса, енді қарастыратын редоксо-жүйеде – инертті болады, сондықтан ол электрондарды иондар арасында тасымалдаушының ролін атқарады.
(Pt)-A (–) Sn2+/Sn4+ || Fe3+/Fe2+ (+) K-(Pt)
Бұл жағдайда көрсетілген тұздар қоспаларынан тұратын жарты элементтерде платина электродын пайдалануға болады.

Редоксожүйенің потенциалы ортаға (рН) байланысты болады:

Бұл мысалдан KMnO4 ерітіндісінің тотықтырғыштық қасиеті қышқылдық ортада жоғары екендігі көрініп тұр (
Тотығу–тотықсыздану реакциясының термодинамикалық негіздері
Заттың тотығу–тотықсыздану қасиеттері сан жағынан олардың тотығу–тотықсыздану потенциалдарының мәндері бойынша анықталады. Редоксо-потенциалдың абсолюттік мәні неғұрлым үлкен болса, оның тотықтырғыш қасиеті соғұрлым жоғары болады және керісінше.
Реакцияның жүру мүмкіндігін Гиббс энергиясының өзгерісінің мәнін есептеу арқылы анықтауға болады. Тотығу–тотықсыздану үрдісінің электр қозғаушы күші мен Гиббс энергиясы байланысы мынадай формула арқылы беріледі:
∆ 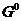 = -nF
= -nF  (9.5)
(9.5)
мұндағы, n – реакцияға қатысатын электрондар саны
F – Фарадей саны, 96500 Кл
E – электр қозғаушы күші, В.
Бұл формуладан гальвани элементі жұмыс істеу үшін және тотығу–тотықсыздану реакциялары көрсетілген бағытта жүру үшін электр қозғаушы күшінің мәні оң болуы қажет, сонда ғана ∆G<0 болады.
Осы жерде §3-тегі 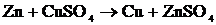 реакциясы кері жүре алмайтындығына көз жеткізуімізге болады. Реакция кері жүреді деп есептесек, Cu - т-с-ш, Zn - т-т-ш болады, сонда
реакциясы кері жүре алмайтындығына көз жеткізуімізге болады. Реакция кері жүреді деп есептесек, Cu - т-с-ш, Zn - т-т-ш болады, сонда  = -0,76 – (+0,34) = -1,1 В, Е<0, сондықтан
= -0,76 – (+0,34) = -1,1 В, Е<0, сондықтан  , олай болса, реакция жүрмейді.
, олай болса, реакция жүрмейді.
Гиббс энергиясының өзгерісі тотығу-тотықсыздану үрдісінің тепе-теңдік константасымен де байланысты:
∆ 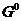 = -RT·lnK = -2,3·RT·lgK (9.6)
= -RT·lnK = -2,3·RT·lgK (9.6)
мұндағы R – универсал газ тұрақтысы
T – абсолюттік температура
K – тепе-теңдік константасы.
(2)-формуладан К>1 болғанда ∆G<0; ал K=1 болғанда ∆G=0, ал K<1 ∆G>0 болатыны көрінеді.
Сонда, (9.5) және (9.6) формулаларды біріктіріп жазсақ, мына теңдік шығады:
пFE = 2,3· RT· lgK (9.7)
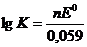 (9.8)
(9.8)
АНАЛИТИКАЛЫҚ ХИМИЯДАҒЫ КОМПЛЕКСТЕРДІҢ ТҮЗІЛУІ
Кешенді қосылыстар, координациялық теория
Біздер химиялық байланысты оқығанда тарту күші тек атомдар арасында ғана емес, сонымен қатар молекула аралық та болатынын қарастырғанбыз.
Д.И.Менделеев пен В.А Каблуковтың ерітінділер жайындағы теориясы бойынша иондар сулы ерітіндіде гидратталған күйде жүреді. Егер натрий хлориді ерітіндісін қарастырсақ, онда Na+ ионын судағы ерітіндіде 6 моль су қоршап жүре алады. [Na(H2O)6]+, Cu2+ ионы аммиактағы ерітіндісінде 4 моль аммиак қоршайды – [Cu(NH3)4]2+ болады. Мұндай күрделі бейорганикалық қосылыстардың құрамы мен құрылысын валенттіліктің классикалық теориясы арқылы түсіндіруге келмейді. Бұл қосылыстарға былай анықтама беруге болады:
Бейтарап молекулаларды не иондарды қосып алып, кристалл тор түйіндерінде және ерітіндіде де жүре алатын иондарды кешенді деп, ал құрамында осындай иондары бар қосылыстарды кешенді қосылыстар деп атайды.
Кешенді қосылыстар құрылысы және қасиеттерін 1893 жылы швейцария ғалымы, Нобель сыйлығының лауреаты А. Вернер ұсынған координациялық теория түсіндіреді.
Бұл теорияның негізгі қағидалары төмендегідей:
a) Кешенді қосылыстарда бір ион не атом орталықтан орын алады, оны кешен түзуші деп атайды.
ә) Орталық ион (атом) айналасында қарама-қарсы зарядты ион не полярлы молекулалар орналасады, оларды лигандтар деп атайды. “Лиганд” деген сөз латынның “ligo” – байланысқан деген мағына береді.
б) Орталық ион (атом) лигандтармен бірге кешенді қосылыстың ішкі координациялық сферасын құрады, оны квадрат жақшаға алып жазады.
в) Кешен түзішумен байланысқан бөлшектердің жалпы санын координациялық сан деп атайды, оның сан мәні көп жағдайда 2, 4, 6, 8, болады.
г) Орталық ионнан едәуір қашықтықта орналасқан иондар кешенді қосылыстың сыртқы сферасын құрады.
д) Орталық ионның (атом) өзінің айналасындағы бөлшектерімен байланыс беріктілігі әртүрлі болады.
А.Вернердің координациялық теориясын орыс ғалымдары Л.А.Чугаев, И.Л.Черняев, А.А.Гринберг т.б. ғалымдар толықтырды.
Кешенді қосылыстардың құрылысын төмендегідей сызбанұсқамен көрсетуге болады:
[NH4]Cl [Cu(NH3)4]SO4









N-3 – комплекс түзуші Сu2+ – комплекс түзуші
[NH4]+ – ішкі сфера NH3 – лиганд
Cl- – сыртқы сфера [Cu(NH3)4]2+ – ішкі сфера
Координациялық сан – 4 SO42- – сыртқы сфера
координациялық саны – 4
Кешен түзуші бола алатындар:
1. Оң зарядты иондар (көбінде қосымша топша металдарының иондары).
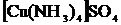
2. Теріс зарядты иондар:
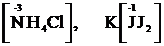
3. Бейтарап атомдар:

Лиганд бола алатындар:
1) теріс тотығу дәрежесін көрсететін иондар: Cl-, OH-, CN-, NO3-, Br-
2) полярлы молекулалар: H2O, NH3, CO, NO, N2H4, μ ≠ 0
3) полярсыз, бірақ оңай поляризацияланатын молекулалар:
H2N – CH2 – CH2 – NH2 (этилендиамин)
Координациялық сан мәндері 2, 3, 4, 5, 6, 7, 8, 9, 12 болуы мүмкін, көптеген қосылыстарда бұл сан 2, 4, 6-ға тең, негізінен кешен түзуші зарядына екі еселі болып келеді.
Кешен түзуші жанынан лигандтардың алатын орнының санына байланысты оларды бір дентантты: J-, Cl-, OH-, NH3-, т.т. және көп дентантты: SO42-, CO32-, PO43- деп бөледі.


Ag(NH3)2Cl [Co(NH3)4CO3]
Координациялық сан кешен түзуші ионның
 2017-12-14
2017-12-14 3432
3432







