М.Б.Усманова
А.А.Тастанбекова
АНАЛИТИКАЛЫҚ ХИМИЯ
5В070900 - Металлургия, 5В073700 – Пайдалы қазбаларды байыту мамандығының студенттеріне арналған дәрістер жинағы
Өскемен
Мазмұны
| Кіріспе Аналитикалық химия және оның негізгі даму кезеңдері | ||
| 1 Аналитикалық анықтаулардың сұлбасы 1.1Әдістеме таңдаудың негізі 1.2 Орта сынама және нақты үлгі алу 1.3 Сынаманы ыдырату (ажырату), еріту 1.4 Бөлу және концентрлеу 1.5 Сандық өлшемдер | ||
| 2 Сапалық анализ негіздері 2.1 Жүйелі және бөлшекті 2.2 Аналитикалық реакциялар және олардың сезімталдығы 2.3 Катиондарды аналитикалық топтарға бөлу | ||
| 3 Бірінші аналитикалық топ катиондарының жалпы сипаттамасы,пайдалануы 3.1 Жалпы сипаттамасы 3.2 Аналитикалық топ катиондарының қоспасын талдап анықтау | ||
| 4 Екінші аналитикалық топ катиондары 4.1 Жалпы сипаттамасы 4.2 Пайдаланылуы | ||
| 5 Үшінші аналитикалық топ катиондары 5.1 Жалпы сипаттамасы 5.2 Пайдаланылуы 5.3 Барий катионының реакциялары 5.4 Кальций катионының реакциялары | ||
| 6 Төртінші аналитикалық топ катиондары 6.1 Жалпы сипаттамасы 6.2 Пайдаланылуы 6.3 Алюминий катионының реакциялары 6.4 Мырыш катионының реакциялары 6.5 Хром катионының реакциялары 6.6 IV- аналитикалық топ катиондарының жүйелік талдауы | ||
| 7 Бесінші аналитикалық топ катиондары 7.1 Жалпы сипаттамасы 7.2 Пайдалануы 7.3 Темір (II) катионының реакциялары 7.4 Темір (III) иондарының реакциялары 7.5 Темір (III) ионының тотықсыздану реакциялары 7.6 Марганец (II) иондарының реакциялары 7.7 Магний (II) иондарының реакциялары 7.8 V аналитикалық топ катиондарының жүйелік талдау жолы | ||
| 8 Алтыншы аналитикалық топ катиондары 8.1 Жалпы сипаттамасы 8.2 Пайдалануы 8.3 Кобальт катионының реакциялары 8.4 Мыс катионының реакциялары 8.5 Никель катионының реакциялары 8.6 Алтыншы аналитикалық топ катиондарының жүйелік анализі | ||
| 9 Аниондардың химико-аналитикалық сипаттамасы 9.1 Аниондардың жіктелуі 9.2 Бірінші аналитикалық топ аниондары 9.3 SO4-2 аниондарының реакциялары 9.4 SO3-2 сульфит иондарының жеке реакциялары 9.5 CO3-2 карбонат иондарының жеке реакциялары 9.6 SiO3-2- аниондарының жеке реакциялары 9.7 Аниондардың II тобы 9.8 CI- ионының реакциялары 9.9 Br- ионының реакциялары 9.10 I- ионының реакциялары 9.11S2-(сульфид) иондарының реакциялары | ||
| 10 Массалар әрекеттесу заңы аналитикалық химияның теориялық негізі 10.1 Массалар әрекеттесу заңының қайтымды реакцияларға қолданылуы 10.2 Электролиттік диссоциация теориясының негізгі қағидалары 10.3 Диссоциация үрдісінің сандық сипаттамалары 10.4 Гидроксидтердің қышқылдық- негіздік диссоциациялануы 10.5 Тұздар диссоциациясы 10.6 Активтілік. Активтілік коэффициентті.Ерігіштік көбейтіндісі. | ||
| 11 Судың иондық көбейтіндісі | ||
| 12 Тұздар гидролизі 13 Аналитикалық химиядағы тотығу - тотықсыздану үрдістері 14 Аналитикалық химиядағы комплекстердің түзілуі 13 Әдебиеттер |
КІРІСПЕ
АНАЛИТИКАЛЫҚ ХИМИЯ ЖӘНЕ ОНЫҢ НЕГІЗГІ ДАМУ КЕЗЕҢДЕРІ
Аналитикалық химия - әртүрлі қосылыстар мен заттардың құрамын анализдеу әдістері туралы ғылым. Олай болса, аналитикалық химияны пәні ретінде анализдің жаңа әдістерін жасауды, анализді практика жүзінде қолдануды және анализ әдістерін терең зерттеу арқылы олардың теориялық негізін қалыптастыруды айтуға болады.
Аналитикалық химия бұл білімді қалыптастырып және оны бір жүйеге келтіретін пән ғана емес, ол қоғам өмірінде практикалық мәні зор ғылым.
Химиялық анализді тиімді түрде жүргізбейінше табиғатты қорғау жэне денсаулық сақтау жүйелері мен қауіпсіздік комплекстерін іске қосу және жандыру, оларды одан әрі дамыту мүмкін болмайды.
Аналитикалық химияда қолданылатын әдістер табиғи зат неден тұрады, оның құрамына қандай компоненттер кіреді, олардың сандық мөлшерлері мен концентрациялары қандай деген сұрақтарға толық жауап бере алады. Сонымен қатар аналитикалық химияның мақсаты анализ әдістерінің қолданылу мүмкіншіліктері мен метрологиялық аспектілерін анықтау және әртүрлі объектілер анализінің әдістемесін жасау болып табылады. Аналитикалық химия бұл таңғажайып ғылыми ізденістердің үлкен бір орталығы деуге де болады.
Аналитикалық химия заттың химиялық құрамын анықтауға қажетті химиялық анализ әдістерін жасап, сол үрдістерді жүзеге асырумен және олардың теориялық негіздерін зерттеу мен шұғылданатын химия ғылымының бір саласы.
Аналитикалық химия студенттердің ойлау қабілеттерін қалыптастыра отырып, химиялық анализді және әртүрлі ғылыми-зерттеу тәсілдерін жүргізуді үйретеді. Жоғары оқу орындарында оқу жоспары бойынша аналитикалық химияға бөлінетін уақыт көбінесе лабораториялық практикумға беріледі, студент жұмыстың теориялық негізін жетік білмесе лабораториялық жұмыс бойынша анализдің жеке сатыларын тек механикалық жолмен ғана жүргізуі мүмкін. Бұндай жағдайда терең білімді қалыптастыру мүмкін болмайды.
Аналитикалық химияның мақсаты - анализдеу әдістерін жасау, оны тәжірибе жүзінде қолдану және бірге аналитикалық әдістердің теориялық негіздерін кейінен зерттеу болып табылады. Әртүрлі орталарда және әр түрлі агрегаттық күйлерде болатын элементтер мен олардың қосылыстарын зерттеу, координациялық қосылыстардың құрамы мен тұрақтылығын, заттың оптикалық, электро-химиялық және басқа да сипаттамаларын анықтау, химиялық реакциялардың жылдамдықтарын зерттеу, әдістердің метрологиялық сипаттамаларын анықтау.
Практикалық мақсаттарда әрдайым толық химиялық анализ жүргізу қажет бола бермейді. Көп жағдайда материалдың сапасын, технологиялық сипаттамаларын, эксплуатациялық қасиеттерін, кейде екі-үш немесе төрт-бес аса маңызды компоненттерді ғана анықтаумен шектеледі.
Қойылған мақсаттарға, талданатын заттың қасиеттеріне және тағы да басқа шарттарға байланысты заттардың құрамы әртүрлі өрнектеледі. Заттың химиялық құрамы элементтердің, оксидтерінің, болмаса басқа да қосылыстарының массалық үлесімен (%), сонымен бірге үлгіде шын мәнінде кездесетін химиялық қосылыстардың немесе фазалардың, изотоптардың жэне т.б. болуымен сипатталады. Құймалардың құрамы әдетте құрамдас элементтердің массалық үлесімен (%) сипатталады; тау жыныстарының, рудалардың, минералдардың және т.б. құрамы олардың қандай да бір қосылыстарына, көбінесе оксидтеріне шаққандағы элементтердің құрамымен анықталады. Талданатын үлгіде кездесетін қандайда бір элементтің жеке химиялық қосылыстар, формалар түрінде сынақта болуын анықтау мақсатындағы фазалық немесе заттық анализ әлдеқайда күрделі. Органикалық қосылыстарды анализдеу кезінде жеке элементтерді (көміртегі, сутегі, азот жэне т.б.) анықтаумен қатар молекулярлы және функционалды анализ жиі жүргізіледі (яғни жеке химиялық қосылыстар, функционалды топтар жэне т.б. анықталады). Аналитикалық химияның теориялық негізін Д.И. Менделеевтің периодтық заңы, зат массасы мен энергияның сақталу заңдары, зат құрамының тұрақтылығы, әрекеттесуші массалар заңдары сияқты жаратылыстанудың негізгі заңдары құрайды. Аналитикалық химия физикамен, бейорганикалық, органикалық, физикалық және коллоидтық химиямен, электрохимиямен, химиялық термодинамикамен, ерітінділер теориясымен, метрологиямен, ақпарат теориясымен және басқа көптеген ғылымдармен тығыз байланысты. Мыс алу, анализдің спектралды әдістері физикалық теориялар негізінде қарқынды дамуда, электроаналитикалық әдістерде теориялық электрохимия мен ерітінділер термодинамикасының ұстанымдары негізге алынады. Заманауи аналитикалык химияны координациялық қосылыстар, кванттық-химиялық әдістер және зат құрылысы теориясы, реакциялар кинетикасы және т.б. негізгі ілімдерсіз елестету мүмкін емес. Осындай ғылымдардың жетістіктерін қолдану арқылы аналитикалық химияның теориялық негізі байып, оның мүмкіндіктері кеңейіп, жаңа міндеттерді шешуге мүмкіндік алады. Сонымен қатар аналитикалық химияда жоғарыда айтылған ғылымдардың және өндірістің тұтас бір салаларының дамуына маңызды әсерін тигізеді, оларға анализдің жетілдірілген әдістерін ұсынып, дамудың жаңа мүмкіндіктерін ашады.
Аналитикалық химияның басқа ғылымдармен, әсіресе өндіріс салаларымен тығыз байланысты болуы оның маңызды ерекшеліктерінің бірі болып табылады. Аналитикалық химиядағы анализ бен синтездің бір-бірімен тығыз байланысты екенінде айта кеткен дұрыс. Анализ түсінігі әдетте заттарды құрамдас бөліктерге болумен ассоциацияланады, бірақ химияльқ анализ бұл көбінесе өзіне тән бояуы бар, нашар еритін және кристалдарының өзіне тән пішіні бар қосылыстардың синтезіне негізделеді. Сонымен бірге, синтездің нәтижесі әдетте анализ арқылы бақыланатындығы да анализ бен синтездің бірлігін көрсетеді.
Аналитикалық химияның ғылыми және тәжірибелік маңызы өте зор. Негізгі химиялық заңдардың барлығы дерлік осы аналитикалық химияның әдістерінің көмегімен ашылған. Әр түрлі материалдардың, бұйымдардың, рудалардың, минералдардың, ай топырағының, алыс планеталар мен басқа да аспан денелерінің құрамы аналитикалық химия әдістерімен анықталған. Периодтық жүйенің толық бір қатарының ашылуы аналитикалық химияның нақты әдістерін қолдану арқылы ғана мүмкін болғандығы белгілі.
Заманауи химиялық зерттеулердің ешқайсысы, жаңа заттарды синтездеу, жаңа технологиялық тізбекті жасау немесе өндірісті интенсивтендіру болсын, өнімнің сапасын арттыру және т.б. болсын, аналитикалық химия әдістерінсіз олардың іске асуы мүмкін емес.
Аналитикалық химияның даму кезеңдері
Аналитикалық химия мен анализ әдістерінің көптеген тәсілдері өте ертеден белгілі. Ең алдымен сынамалық сулы немесе «құрғақ» түрде, сынаманы ерітпей, яғни ерітінділерді қолданбай сынамалы анализдеу болды, Сынамалы анализ үрдістері арқылы қымбат металдардың тазалығын бақылап, олардың кен мен құймалардың құрамындағы мљлшерін анықтаған. Сынамалы анализді жүргізу техникасы қымбат металдарды алудың өндірістік үдерісін лабораториялық жағдайда жүргізуге мүмкіндік берді. Анализдің мынадай әдістері Ежелгі Египет пен Грецияда қолданылған. Ол кезде ерітіндідегі реакцияның практикалық маңызы оншалықты болмайтын.
XVII ғасырдың ортасында өнеркәсіп пен әртүрлі өндірістің дамуы анализ бен зерттеудің жаңа әдістерін қажет етті. Себебіі сынамалы анализ химиялық және басқа да өндірістерді қанағаттандыра алмады. XVII ғасырдың ортасын аналигикалық химияның пайда болуы және химияның ғылым ретінде қалыптасуы деп есептейді. Кеннің, минералдардың және басқа заттардың құрамын анықтау үлкен қызығушылық тудырды.
XVII - XVIII ғасырларда «пробиркалық анализ» кең қолданылды. Осындай анализдің көмегімен бағалы металдардың тазалығын тексеріп, олардың рудадағы мөлшерін анықтаған. Сондықтан бұл кезде химия ғылымындағы зерттеудің негізгі үрдісі химиялық анализ болды. Р. Бойль (1627-1691) «химиялық анализ» деген терминді ұсынып, химиялық анализ туралы жалпы түсінікті қалыптастырды. Сонымен бірге ол заманауи сапалық анализдің «сулы» жолын ұсынып, осылайша реакцияны ерітіндіде жүргізудің негізін салды. Сол кезде белгілі болған сапалық реакцияларды бір жүйеге келтіріп жэне бірнеше жаңа сапалық үрдістерді (аммиакқа, хлорға және т.б) ұсынды, қышқылдар мен сілтілерді анықтау үшін лакмусты қолданды жэне тағы да басқа маңызды жаңалықтар ашты.
Аналитикалық химия жеке ғылым болып тек М.В. Ломоносовтың жұмыстарынан кейін, әсіресе зат массасының сақталу заңы ашылғаннан соң ғана, яғни химиялық өндірістерде сандық есептеулер жүргізілуіне байланысты қалыптаса бастады.
М.В. Ломоносов (1711-1765) химиялық реакцияларды зерттеу кезінде алғашқы рет таразыны жүйелі түрде қолданған.
1756 жылы ол сандық анализдің негізін құрайтын жэне бүкіл ғылым үшін зор маңызы бар, табиғаттың негізгі заңдарының бірі - зат массасының сақталу заңын экперимент жүзінде дәлелдеді. Бұл заңның сандық анализдің негізін қалыптастырудағы және жалпы аналитикалық химия ғылымының дамуындагы маңызы өте зор болды. М.В. Ломоносов химиялық анализбен ғылыми-зерттеудің қазіргі кезге дейін өздерінің құндылығын жоймаған көптеген тәсілдерін ұсынды, олар: вакуумда сүзу, гравиметриялық анализ операциялары және сонымен бірге М.В. Ломоносов газды анализдің негізін қалыптастырды, рефрактометрді құрастырды және сапалық анализде микроскопты қолдануды ұсынды, осылайша микрокристаллоскопиялық анализ бастама алды. Химик-зерттеуші, аналитик және технолог ретінде жасаған ғылыми еңбектерінің нәтижелерін М.В. Ломоносов «Металлургия немесе рудалармен жұмыстардыћ алғашқы негіздері» («Первые основания металлургии или рудных дел») деген кітабына жинақтап ұсынды. Бұл кітап аналитикалық химиямен оған іргелес ғылым салаларының дамуына, металлургия мен рудалар анализінің дамуына зор ықпал етті.
Химиялық анализдің дәлдігі жоғары үрдістерін қолдану көптеген табиғи заттардың және технологиялық өнімдерінің құрамдарын анықтауға және химия ғылымының бірқатар заңдарының ашылуына әсерін тигізді. А.Л.Лавуазье (1743-1794) ауаның, судың және басқа да заттардың құрамын анықтады, жанудың оттектік теориясын қалыптастырды. Д.Дальтон (1766- 1844) заттың атомдық теориясын дамытты және құрам тұрақтылығы мен еселік қатынас заңын дәлелдеді.
Ж.Л.Гей- Люссак (1778-1850) пен А.Авогадро (1776-1856) газдар заңын қалыптастырды Аналитикалық химия жаңа әдістермен толықтырыла отырып, одан әрі дамып, жетілдірілді.
XVIII ғасырдың соңында Т.Е.Ловиц (1757-1804) М.В. Ломоносовтың идеясын дамыта отырып, кристалдар формасы мен олардың химиялық құрамы арасындагы өзара байланыстыр бар екендігін ашып, сапалық анализдегі тұздардың кристалдары формасы бойынша үрдісті-микрокристаллоскопиялық анализдід негізін салды.
М.В.Севергин (1765-1826) ерітінді түсінің қанықтығы мен концентрациясы арасындағы байланысқа негізделген колориметрлік анализді ұсынды. Сонымен қатар М.В.Севергин химиялық анализ бойынша бірнеше жетекші-еңбектер шығарған.
Ж.Л.Гей-Люссак «титрлеу» деген терминді енгізіп, анализдің титриметриялық әдісін жасады. Бұл әдіс гравиметриялық әдіспен бірге классикалық аналитикалық химияның негізін қалады..
XVIII ғасырдың аяғы мен XIX ғасырдың басында көптеген ғалымдар - Т.У. Бергман (1735-1784), Л.Ж. Тенар (1777-1857), К.К. Клаус (1796-1864 жүйелі (систематикалық) сапалық анализдің негізін қалады. Бұл жұмыстарды К.Р. Фрезениус (1818-1897) аяқтап, сапалық және сандық анализ бойынша оқулық жазды..
И.Я. Берцелиус (1779-1848) пен Ю. Либих (1803-1873) органикалық қосылыстардың құрамындағы негізгі элементтерді - С, Н, N жэне т.б. анализдеу әдістерін дамытты. Титриметриялық анализде қарқынды дамып, оның иодометрия, перманганатометрия сияқты түрлері пайда болды.
1859-1860 жылдары Р.В. Бунзен (1811-1899) мен Г.Р. Кирхгоф (1824- 1887), олар аналитикалық химияның негізгі әдістерінің бірі және осы күнге дейін даму үстіндегі спектральды анализді ұсынады.
Н.С. Курнаков ұсынған (1860-1941) «құрам-қасиет» диаграммасын зерттеуге негізделген физика-химиялық анализ әдісі химияның бір бөлімі болып қалыптасты. Бұл әдіс күрделі жүйелерде енгізілетін қосылыстардың құрамдары мен қасиеттерін жеке қосылыстарды кристалл түрінде болмай-ақ анықтауға мүмкіндік ашты.XIX- ғасырдың екінші жартысында аналитикалық химия үшін металдардың органикалық заттармен түзетін комплексті қосылыстарын зерттеудің мәні өте зор болды.
Л.А. Чугаев (1873-1922) 1905 жылы диметилглиоксим реактивін никельді ашуда қолдануды ұсынды.
Аналитикалық химияның одан ірі дамуы химиялық реакциялардағы тепе-теңдіктерді ашқан Н. Н. Бекетовтың (1827-1911) және әрекеттесуші массалар заңын ашқан К. М. Гульдберг (1836-1902) пен П. Ваагенің (1833-1900) аттарымен байланысты. 1887 жылы С. Аррениустің (1859-1927) электролиттік диссоциация теориясы пайда болғаннан кейін химик-аналитиктер химиялық реакцияларды сандық жағынан тиімді басқаруға қол жеткізді, ал химиялық термодинамиканың жетістіктері бұл мүмкіншілікті одан әрі кеңейтті.
(1853-1932) В.Оствальдтың 1894 жылы жарық көрген «Научные основы аналитической химии в элементарном изложении» деген монографиясы аналитикалық химияның теориялық негіздерінің дамуына үлкен роль атқарды.
Ғасырдың 20-шы жылдарынан бастап сандық эмиссионды спектральды анализ, абсорбциялық спектроскопия қарқынды дами бастады, жарықтың қанықтығын өлшейтін құрылғылар жасала бастады.
1925 жылы Я. Гейровский (1890-1967) полярографиялық анализ әдісін жасап ұсынды. Бұл еңбегі үшін ол 1959 жылы Нобель сыйлығын алды. Осы жылдары хроматографиялық, радиохимиялық және тағы да басқа анализ әдістері дамып жетіле бастады.
1959 жылдан бастап Э. Уолш ұсынған атомды- абсорбциялық спектроскопия қарқынды түрде дамыды.
Өндіріс пен ғылымдағы дамулар аналитикалық химиядан жаңа әдістерді талап етті. Осылайша қоспалардың сандық мөлшерін 10-6-10-7 және одан да төмен дәрежеде анықтаудың қажеттігі пайда болды.
Қолданылатын әдістер
Химиялық жүйе жеке қосылыс, заттар қоспасы, заттың сапалық және сандық құрамы болады.
Сапалық құрам - зат құрамындағы белгілі бір элементтердің, функционалдьды топтардың, иондардың барын көрсетеді.
Сандық құрам – зат құрамындағы белгілі бір бөлшектердің мөлшерін көрсетеді. Сапалық және сандық кұрамдарды химиялық анализ әдістері арқылы анықтайды.
Химиялық анализ әдістері беске бөлінеді.
1.Химиялық әдістер - химиялық реакцияларға негізделген, анализдің эффектісін визуальды түрде көзбен көріп байқауға болады
2.Физикалық әдістер - заттардың физикалық қасиеттерін өлшеуге негізделген, бұл әдісте химиялық реакциялар қолданылмайды. Мысалы: поляризациялану кеңістігінің ауысуы, жарық сәулесінің ерітінде сынуы, заттардың оптикалық спектрлері.
3.Физика-химиялық әдістер - химиялық немесе электрохимиялық реакциялардың жүруі барысында заттардың физикалық қасиеттерінің өзгеруін байқауга негізделген үрдістер. Физикалық және физика-химиялық үдістерді біріктіріп, құралдық (интрументальды) әдістер деп атайды
4.Биологиялық үрдістер - әртүрлі объектілердің биологиялық активтілігін зерттеуге негізделген жэне химиялық реагенттердің биологиялық объектілерге әсерін зерттеуге негізделген үрдістер.
5. Аналитикалық химияда бөлу әдістері жэне анықтау әдістері бар. Бөлу әдістерінің негізгі мақсаты кедергі келтіретін компоненттерді бөлу немесе анықталатын компоненттерді сандық жағынан анықтауға қолайлы түрде бөліп алу болып табылады. Бірақ, көбінесе, қызықтыратын компонентті анықтау алдын-ала бөлусіз, сынақтың өзінде-ақ жүргізіледі. Кейбір жағдайларда бөлу және анықтау әдістері бір-бірімен тығыз байланыста болып, толық бір әдісті құрайды. Осындай әдіске газды хроматография жатады. Хроматография процесінде қоспаны жеке компоненттерге бөледі және олардың сандық құрамы анықталады. Анализдің мұндай әдістері бөлу мен анықтаудың бір-бірімен тығыз байланысты екенін көрсетеді және олар гибридті әдістер деп аталады.
Химиялық анализ әдістерін мынадай белгілер бойынша топтауға болады:заттың агрегаттық күйі бойынша, анализге алынған заттың мөлшері бойынша, анализдің орындалу техникасы бойынша
1- кесте
| Ескіше атаулар | Жаңа атаулар | Зерттелетін заттардың мөлшері |
| Макроанализ Жартылай микроанализ Микроанализ Улътрамикроанализ Субмикроанализ | Грамм-әдісі Сантиграмм-әдісі Миллиграмм-әдісі Микрограмм-әдісі Нанограмм-әдісі | 1-10 грамы 0,05-0,5 грамы 10-3-10-6 10-6-10-9 10-9-10-12 |
Химиялық лабораторияда оқыту мақсатында жартылаймикроанализ жүргізіледі, сезімталдығы жоғары реакциялар қолданылады және бұндай реакциялар анықталатын ерітіндідегі бөлшектердің өте азғантай мөлшерін анықтауға мүмкіндік береді. Реакциялар микрокристаллоскопиялық немесе тамшылы әдістермен орындалады. Микрокристаллоскопиялық әдісте реакциялар әдетте заттық шыныда жүргізіледі, анықталатын ионның бар-жоғын кристалдар формасын микроскоп арқылы қарап болжайды немесе тамшылы әдісте ерітінді түсін өзгерте жүретін немесе нәтижесінде түсті қосылыстар, түсті тұнба түзілетін аналитикалық реакциялар қолданылады. Бұндай реакциялар көбінесе фильтр қағазында орындалады.
Аналитикалық реакциялар «құрғақ» және «ылғал» жолмен орындалады. «Құрғақ» реакциялар қосымша роль атқарады және алдын-ала жүргізілетін зерттеулерде, сонымен қатар «ылғал» реакция жүргізу мүмкін болмайтын жағдайларда жасалады. Көбіне көп «ылғал» реакциялар қолданылады. Оларды жүзеге асыру үшін алдымен затты ерітеді. Еріткіш ретінде әдетте су, кейде қышқылдар мен сілті қолданады.
Бейорганикалық заттардың сапалық анализінде негізінен тұздар, қышқылдар және сілтілер ерітінділерімен жұмыс жасайды. Бұл заттар электролиттер болып табылады, яғни олар сулы ерітінділерінде иондарға диссоциацияланады. Сондықтан реакция иондар арасында жүреді, яғни сапалық анализде элементтерді емес, иондарды ашу реакциялары жасалады.
1) Белгілі бір аналитикалық реакцияны орындау үшін белгілі бір жағдай жасау қажет: ерітінді ортасы (рН), мысалы кейбір тұнбалар қышқылдарда жақсы ериді, сондықтан орта қышқыл болса, онда тұнба түзілмейді немесе кейбір тұнбалар сілтілерде жақсы ериді, яғни бұндай тұнба сілтілі ортада түзілмейді. Ал кейбіреулері қышқылдарда да, сілтілерде де ериді, оны тек бейтарагі ортада ғана алуға болады. Демек, реакция толық жүруі үшін қажетті орта болуы керек.
2) ерітінді температурасы. Кейбір реакцияларды салқын ортада жүргізу керек болады немесе керісінше, ал ерігіш тұнбалар температура артқан сайын әрекеттеседі.
3) Ерітіндідегі анықталатын ионның концентрациясы жеткілікті түрде мейлінше үлкен болуы керек. Концентрациясы өте аз болса реакция дұрыс жүрмейді. Мысалы, тұнба ерігіш болса, тұнба түзетін ион концентрациясы тұнбаның ерігіштігінен жоғары болған жағдайда ғана тұнба түзіледі. Ал қиын еритін тұнба үшін аз ғана концентрацияның өзі жеткілікті болады.
Химиялық анализде қолданылатын реакцияларға мынадай талаптар қойылады:
1) реакция тез орындалатын және қайтымды болуы;
2) аналитикалық сигналы (түстің болуы, тұнбаның түзілуі, газдың бөлінуі) бар реакциялар болуы;
3) сезімталдығы жоғары реакциялар болуы;
4) таңдамалылығы жоғары реакциялар болуы керек.
Заттың қасиетіне қарай классификациялаған кезде анализдеу әдісі өлшенетін қасиеттін атын сақтайды. Егер тұнбаның массасы өлшенетін болса, әдіс гравиметриялық деп, егер ерітінді түсініп интенсивтігі анықталатын болса - фотометриялық немесе спектрометриялық деп, ал егер электр қозғаушы күші (ЭҚК) өлшенетін болса - потенциометриялық деп аталады және т.б.
Көбінесе анықтау әдістерін анализдің физикалық әдістерінің тобын айшықтай отырып, химиялық және физика- химиялық деп бөледі. Химиялық немесе классикалық анализ гравиметрикалық және титриметрикалық әдістерді жатқызады. Физика-химиялық және физикалық анализ әдістерінде заттың эмиссионды спектроскопияда спектралды сызығының интенсивтігі, полярографияда диффузионды токтың шамасы сияқты және т.б. қасиеттері байқалады немесе өлшенеді.
АНАЛИТИКАЛЫҚ АНЫҚТАУЛАРДЫҢ ЖАЛПЫ СҰЛБАСЫ
Әдістеме таңдаудың негізі
Анализді жүзеге асыру үшін анализге қойылатын талаптар: қанағаттандыратын, жылдамдық, тиімділікті жоғары дәрежеде қамтамасыз ететін әдісті таңдап алу.
Анализдің жалпы операциялары:
1) сынаманы іріктеу, орта сынама және нақты үлгі алу;
2) сынаманы ыдырату (ажырату), еріту;
3) бөлу (анықталатын компонентті бөліп алу) және концентрлеу;
4) сандық өлшемдер;
5) анализ нәтижелерін есептеу.
Әрбір әдістемеде бұл кезеңдердің бәрі бірдей орындалмайды, кейде сынаманы еріту немесе алдын ала компоненттерді бір-бірінен бөлудің қажеттілігі болмайды.
Мысалы, металдар мен құймалардың эмиссионды-спектроскопиялық анализінде немесе кейбір радиометриялық әдістерде бұл операциялар орындалмайды.
Орта сынама және нақты үлгі алу
Өндірістегі химиялық анализдің міндеттері: шикізаттың, кендер мен қосалқы материалдар, отын және тағы басқалардың орташа құрамын анықтау.
- негізгі сынама анализденетін материалдардың орташа құрамын көрсетуі керек;
- анализ нәтижелері анализдеуге алынған заттың ғана құрамын көрсетеді;
- негізгі сынаманың нәтижесін барлық партияға тән нәтиже ретінде қарастыруға болады.
- анализденетін зат қатты, сұйық, газ күйінде болуы керек;
- анализдеу үшін сынаманы белгілі мөлшерде алыну керек;
- сынаманың құрамы анализденетін заттың құрамына түгелімен сәйкес болуы керек.
Анализді механикалық, химиялық әдіспен дайындайды. Зат газ, сұйық күйінде болатын болса, олардың гомогенді болуына байланысты олардан құрамы анализденетін заттың құрамына түгел сәйкес болатын сынама дайындау қиын емес.
Қатты зат - әртүрлі компоненттердің гетерогенді қоспасы. Сынаманы дайындаған кезде түйіршікті затта бір компонент бір жерінде көп немесе керісінше аз болуы да мүмкін, сондықтан заттың әр жерінен алынған сынаманың құрамы әртүрлі болады. Қатты заттан сынама алу, анализденетін материал ірі, әртүрлі өлшемдегі кесектер болған жағдайда қиындық туғызады. Анализденетін материалдың үлкен партиясынан негізгі сынаманы дұрыс таңдау үшін осы операцияның қателерін ең төменгі мәнге дейін жеткізуге мүмкіндік беретін арнайы әдістемелер жасалған. Бұл әдістемелер, әдетте тиісті аналитикалық стандарттарға немесе сынаманы таңдауға арналған арнайы нұсқауларға енгізілген. Бұндай материалдардан негізгі сынама алудың кең таралған түрі, бұл анализденетін заттың барлық көлем бойынша әр жерінен жүйелі түрде біркелкі алынуы.
Сынама алу қателігі - зат түйіршіктеріні мөлшері өскен сайын және сынама мөлшері азайған сайын өседі, сынама өте аз мөлшерде алынатын анализдеу әдістері (микро-анализ) үшін сынаманы өте жоғары дәрежеде гомогендеу керек. Егер анықталатын компонент сынаманың өте азғантай бөлігін құраса және сынамадағы жеке компоненттердің тығыздықтары әртүрлі болса, сынама алу қиындай түседі. Сынаманы алмас бұрын анализденетін затты жақсылап араластыру керек. Анализ жасау үшін алдымен сынаманы азайтып алу керек, сонымен қатар, сынаманы жақсылап ұсақтау қажет.
Орташа сынаманың мөлшерін мына теңдеу бойынша есептейді:
q=K  dα
dα
q - орташа сынаманың мөлшері, кг;
d - түйіршік диаметрі, мм.
Егер d=0,1 мм болса, онда q = 0,1-0,12 = 0,001 кг = 1г.
Негізгі сынаманың массасы салыстырмалы түрде үлкен болады. Сынаманы азайтуды бөлшектеу, кварттау, шаршылау, механикалық бөлгіштердің, арнайы диірменде, ұсақтағыштарда ұсақтайды және орта сынаманы автоматтандырылған сынама алғыштың көмегімен де алуға болады.
Кварттау к езінде сынаманы төртбұрыш түрінде жайып қояды да, төрт үшбұрышқа диагоналдарымен бөледі, екі қарама-қарсы бөліктерді лақтырып тастайды, ал қалған екеуін қосады, тағы да ұсақтайды, кварттайды, яғни 4 бөлікке бөледі және екі қарама-қарсыларын лақтырып тастайды. Осындай жолмен алынған орта сынама бірнеше он шақты массадан 1 кг дейінгі материалдың ұсақталған түріне байланысты, тиісті елеуіш арқылы қалдықсыз еленеді және берік тығыны бар шыны ыдысқа салынады. Талдау үшін алдын ала алынған үлгінің бірнеше сынамасы агаттық ступкада қосымша ұқаланады. Металдық үлгінің орта сынамасы бұрғылап немесе станокта жоңқасын алумен тандалады. Бөлшектеуді, яғни кварттауды сақина және конус тәсілдері арқылы іске асырады. Бұдан басқа да тәсілдері бар. Шаршылау кезінде сынаманы сызғыштың көмегімен тегіс және таза жерге тегістеп жаяды, содан соң шахматтық реттегі квадраттардан сынама алады. Егер сынаманы саусақпен сипап немесе уқалап көргенде, оның түйіршіктері қолға білінбейтін болса, онда ол сынаманың жақсы ұсақталғанының белгісі. Анализ жасау үшін анализденетін сынаманың қатты не сұйық күйіндегі белгілі мөлшерін дәл өлшеп алу керек.
Барлық жағдайда орта сынаманы тандау үлкен ұқыптылықты қажет етеді, егер анализденетін материалдың орташа сынамасы оның шынайы құрамын емес, кездейсоқ құрамын құраса, анализ нәтижесі өз құндылығын жояды.
Мысалы, бастапқы шикізат компоненттері жөнінде қате немесе толық емес мәлімет берілсе, сынаманы таңдау кезінде пайда болған қателер нәтижесінде технологиялық үдеріс кезінде кедергілер туғызуы мүмкін.
Дайындалған орта сынамадан анализ үшін қажетті нақты үлгіні аналитикалық таразыда өлшеп алады. Сынамада анықталған компоненттің құрамы мен сандық өлшемдеріне сүйене отырып, нақты үлгінің шамамен алынатын массасын алдын ала анықталатын компоненттің сынамадағы мөлшерін және колданылатын сандық өлшеулердің ерекшеліктерін ескере отырып есептеп алады. Мысалы, гравиметриялық анализде нақты үлгінің массасын құрышталған тұнбаның массасы 0,05 - 0,3 грамм болатындай етіп есептеп алады. Массаны азайтқан сайын өлшеудің салыстырмалы қателері өседі, ал тұнба массасының өсуі ешқандай артықшылық бермейді, керісінше анализдің ұзақ уақытқа созылуына әкеліп соғады. Аналитикалык нұсқауларда әдетте үлгінің массасы немесе оны есептеу жолдары көрсетіледі. Ауада құрғақ, яғни гигроскопиялық емес сынаманы өлшеу аса бір сақтықты қажет етпейді. Гигроскопиялық сынаманы өлшеу кезінде қажет болатын сақтық шаралары аналитикалық нұсқауларда көрсетіледі.
Сынаманы ыдырату (ажырату), еріту
Бұл операцияны жүргізу кезінде сынаманың барлық анықталатын компоненттерін түгелдей ерітіндіге ауыстыру, еріту кезіндегі қыздыруды немесе тағы да басқа операцияларды орындағанда компоненттерді жоғалтып алмау керек.
Қатты заттың нақты үлгісін еріту үшін әдетте сынаманы минералды қышқылдармен құм немесе су моншасында қыздыру арқылы өңдейді. Көбінесе қышқылдар қоспасы, мысалы «патша сұйығы» (концентрленген тұз және азот қышқылдарының қоспасы) немесе қышқыл мен тотықтыргыштың (сутегінің асқын тотығы мен бромның) қоспасы немесе (кейде) қышқылдар мен тотықсыздандырғыш қоспасы жиі қолданылады. Сынаманың негізгі компоненттері алдын-ала алынған мәліметтерден белгілі болғанда еріткішті таңдау оңай болады.
Мысалы, көптеген сульфидті кендерді өңдеуде алдымен тұз қышқылын қосып қыздырады, содан соң азот қышқылымен тұз қышқылының жаңа үлесін қосады. Ыдыратуды көбінесе сынамаға күкірт қышқылын қосып кыздырумен аяқтайды. Кеннің құрамындағы қорғасын, мыс және тағы басқа да металдар осылайша анықталады. Егер де күкіртті анықтау қажет болса, онда сульфидті сулфатқа дейін тотықтыру үшін және күкірттің өзін күкіртті сутек түрінде жоғалтпас үшін сынаманы концентрлі азот қышқылы түтінімен, кейде бромның қоспасымен өңдейді.
Сурьма, мышьяк, германий және кейбір басқа элементтерді анықтауда бастапқы сынаманы тұз қышқылымен өңдемеуге және тұзқышқылды ерітінділерді қыздырмауға тырысады. Егер бұл элементтерді анализдеуді қыздырусыз жүргізу мүмкін болмаса, онда хлоридтердің ұшып кетуінен туындайтын шығынды болдырмас үшін кері тоңазытқышты қолданады.
Еріту кезінде сирекірек қышқылдардың тотықсыздандырғыштық қасиеттерін де қолданады. Бұндай жағдай, яғни тұз (хлорлы сутек) қышқылын қолдану пиролюзитті (MnO2) және тағы басқа да тотыққан кендерді ерітуде қолданылады. Бұнда пиролюзиттің нақты үлгісін тұз (хлорсутек) қышқылымен бос хлордың бөлінуі тоқтағанша өңдейді. Сынаманың құрамында табиғи органикалық қосылыстардың болуы бейорганикалық анализдің жүруін қиындатады. Органикалық заттар анықталатын элементтермен комплекстер түзуі мүмкін, бұндай комплекстер тұнбаның түзілуіне кедергі келтіреді немесе басқа да аналитикалық операциялардың тиімділігін төмендетеді. Сонымен, анализді жүргізу үшін әдетте сынаманың органикалық бөлігін толық бұзу қажет болады. Бұзуды«құрғақ» немесе «ылғалды» әдістермен жүзеге асырады. «Құрғақ» әдіске сынаманы от жалынында, муфелді пеште, түтікті пеште құрыштап қыздыру, оттек ағынында немесе «жарылғышта» өртеу жатады. Ылғалды әдіс бойынша өртеу кезінде сынаманы ұзақ уақыт бойы концентрлі азот қышқылымен немесе азот қышқылы мен күкірт қышқылының қоспаларымен, кейде тотықтырғыш (хлорат, перманганат және тағы басқалар) қоса отырып өңдейді.
Кейбір материалдарды, мысалы, силикаттарды, отқа төзімді түрлі тау жыныстары мен тағы басқаларын ыдырату кезінде сынаманы толық еріту үшін оны тек еріткішпен өңдеу жеткіліксіз болады. Мұндай жағдайда сынаманы ыдырату (ажырату) үшін әр түрлі балқытқыштар арқылы балқытуды қолданады. Қарапайым балқытқыш ретінде сілтілік металдардың қосылыстарын, яғни олардың карбонаттарын, бораттарын, пероксидтерді, гидроксидтерді және тағы да басқа сілтілік балқытқыштарды немесе гидросульфаттарды, пиросульфаттарды және одан да басқа қышқылдық балқытқыштарды қолданады. Балқыту кезінде әдетте анализденетін зат ыдырайды, бұл кезде сынама компоненттері ауадагы оттегімен тотығады. Балқытқыштың тотықтырғыштық әсерін күшейту үшін оған кейде нитраттар, хлораттар немесе басқа да тотықтырғыштарды қосады.
Балқытқышты таңдау анализденетін сынаманың құрамына байланысты болады. Силикаттар, фосфаттар және тағы да басқа тотыққан минералдарды әдетте натрий карбонаты немесе натрий мен калий карбонаттарының қоспасымен балқытады. Танталаттарды, ниобаттарды және көптеген оксидтерді пиросульфатпен балқытады. Бұлардан да басқа балқытқыштарды қолданады. Кейде оксидпен немесе қорғасын карбонатымен, висмуттың негізгі нитратымен, бор қышқылымен және т.б. балқыту тиімді болады. Сынаманы ыдыратуға көп жағдайда аралас тәсілдерді қолдануға тура келеді - алдымен алынған сынаманы қыздырады және қышқылмен өңдейді, содан соң ерімей қалған қалдықты қолайлы балқытқышпен балқытады. Балқытылғаннан кейін сынама массасы суда немесе сұйытылған минералды қышқылдарда оңай ериді.
Бөлу және концентрлеу
Анализденетін сынамада анықталатын компонентпен қатар бөгде немесе кедергі жасайтын заттар болады, олар қажетті элементті тікелей анықтауда қиындық туғызады.
Егер ерітіндіден бірнеше компонентті анықтау керек болса, онда аналитикалық міндеттің орындалуы да қиындай түседі. Анализденетін компонентті күрделі қоспалардан бөліп алу үшін әртүрлі бөлу әдістерін қолданады. Бөлу әдісін анықталатын қосылыс пен кедергі келтіретін элементтердің физика-химиялық қасиеттеріне байланысты таңдайды. Тәжірибеде бөлудің химиялық, физика-химиялық және физикалық әдістері қолданылады. Бөлудің химиялық әдістері заттардын ерігіштіктерінің әртүрлі болуына және тұнба алу реакциялары мен аз еритін қосылыстардың еруіне негізделген. Кедергі келтіретін компоненттерді қолайлы лигандпен берік комплексті қосылысқа айналдыру арқылы олардың әсерін бүркемелеу өте тиімді тәсіл болып табылады. Бұл кезде анықталататын компонент комплекс түзбейді немесе комплекс түзілген жағдайдың өзінде оның тұрақтылығы өте төмен болады. Мысалы, темір (III) әдетте фторидпен жиі бүркемеленеді.
Тәжірбиеде бөлудің экстракция, ионды алмасу, хроматография, электрохимиялық процестер және т.б. сияқты тәсілдері кеңінен қолданылады.
Бөлу әдісін микромөлшерлерді концентрлеуде де қолданады. Осы кезде алынған концентраттағы анықталатын компоненттің құрамы бірнеше рет артады, сөйтіп анықтау шегі айтарлықтай төмендейді.
Сандық өлшемдер
Сандық өлшемдерде аналитикалық сигналдың қанықтығын анықтайды, яғни анализденетін компоненттің құрамына немесе мөлшеріне байланысты болатын қасиетінің сандық мәні өлшенеді.
Гравиметриялық анализде аналитикалық сигналдың қанықтығы ретінде кептірілген немесе құрышталған тұнбаның массасы алынады, ал титриметрияда - реакцияға жұмсалған ерітіндінің көлемі, фотометрияда - ерітінді түсінің қанықтығы (оптикалық тыгыздық) және тағы басқалар алынады. Сандық өлшем нәтижелері бойынша сынамадағы анықталатын элементтің құрамын байланыс теңдеуін қолданып есептейді. Байланыс теңдеуі аналитикалық сигналдың қанықтығы (өлшенетін шама) мен анализденетін компоненттің құрамы немесе саны арасындағы сандық байланысты көрсетеді:
P = f(c)
Р-аналитикалық сигналдың қанықтығы; с - концентрация. Функционалдық байланыстың түрі аналитикалық сигналдың ерекшеліктерімен анықталады. Байланыс түзу сызықты, логарифмдік және т.б. болуы мүмкін. Байланыс теңдеуі ретінде теориялық негізі бар қатынастарды да, сонымен қатар сигнал қанықтығы мен концентрация арсындағы эмпирикалық жолмен табылған қатынастарды да қолдануға болады.
Талдау нәтижелерін есептеу - бұл анализдіц қорытынды кезеңі. Нәтижелерді есептеу жеңіл теңдеулерді қолдануға негізделген және айтарлықтай қиыншылықтар тудырмайды. Дегенмен, бұл кезең үлкен ұқыптылықты талап етеді, өйткені есептеудегі қатеде басқа анализ операцияларын орындаудағы ұқыпсыздық, дұрыс орындамау және немқұрайлылықтар жалған нәтижеге әкеледі. Анализ нәтижесін есептеумен қатар, алынған мәндердің де қателерін есептеу қажет, өйткені кез келген өлшеу нәтижесінің қатесі анықталып, белгілі болған кезде ғана оның нақты құндылығы болады.
АНАЛИТИКАЛЫҚ ХИМИЯНЫҢ МЕТРОЛОГИЯЛЫҚ НЕГІЗДЕРІ
Метрология (грекше metron - өлшеу және (logos - ұғым, ілім, ғылым) - өлшеу туралы, өлшеудің әдіс-тәсілдері туралы ғылым. Метрологияның ғылым салаларындағы, соның ішінде химиялық анализдегі маңызы өте зор. Химиялық анализ метрологиясы
- стандарттауға
- өнеркәсіпті интенсивтендіруге
- өнімнің сапасын жоғарылату
- қоршаған ортаны қорғау және т.б.
Химиялық анализ - күрделі және көп сатылы үрдіс, нысанның анализін мынадай кезеңдерге бөлуге болады:
- мақсатты айқындау
- әдіс пен анализ жобасын таңдау
- сынаманы таңдау,анализге дайындау, өлшеу жүргізу, нәтижелерін өңдеу. Химиялық анализ әдісін таңдау мен өлшеу нәтижелерін өңдеуді, сонымен бірге «өлшеу» кезеңінің кейбір жалпы ережелерін қарастырамыз.
Химиялық анализдің негізгі мақсаты - зат мөлшерін анықтау, сондықтан, анализ кезеңдерін қарастырудан бұрын осы оқулықта қолданылатын зат мөлшерінің өлшем бірліктері мен концентрацияны белгілеу жолдарын келтірсек.
Зат мөлшерінің өлшем бірліктері және концентрацияны өрнектеу жолдары
Зат мөлшері ( ) бірлігіне моль қабылданған. Кез келген заттың 1 молінде Авогадро санындай 6,02·1023 құрылыс бірлігі (атом, молекула, ион) болады.
) бірлігіне моль қабылданған. Кез келген заттың 1 молінде Авогадро санындай 6,02·1023 құрылыс бірлігі (атом, молекула, ион) болады.
NA= 6,02·1023 моль-1, H2 – 1 моль, 5H2 – 5 моль
Заттың белгілі бір мөлшерінің массасын, газ болса көлемін, затты құрайтын құрылыс бірліктерінің санын анықтайтын формула:

 (1.1)
(1.1)
мұнда, М – молярлық масса, Vm – мольдік көлем, m – масса, V – көлем, N – бөлшектің құрылыс бірлігінің саны.
Моль деп 0,012 кг көміртек изотобында ( ) болатын атом санындай құрылыс бірлігі бар зат мөлшері.
) болатын атом санындай құрылыс бірлігі бар зат мөлшері.
Молярлық масса деп зат массасының зат мөлшеріне қатынасымен анықталатын шаманы айтады.
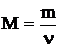
 (1.2)
(1.2)
Заттың молярлық массасы сан жағынан оның салыстырмалы молекулалық массасына тең болады.
Химияда атом мен молекуланың абсолюттік массалары өте аз шама болуына байланысты салыстырмалы шамаларды қолданады.
1961 жылы атом, молекула массасының бірлігі ретінде көміртек изотобының ( ) массасының
) массасының  бөлігі қабылданған, ол - атомдық масса бірлігі (ат.м.б.).
бөлігі қабылданған, ол - атомдық масса бірлігі (ат.м.б.).
1 ат.м.б. = 
 (1.3)
(1.3)
ma ( ) =
) =  , ат.м.б =
, ат.м.б = 
Салыстырмалы атомдық масса деп элементтің табиғи изотоптарының орташа массасының атомдық масса бірлігіне неше еселі екендігін көрсететін шама:
Ar (эл-т) =  (1.4)
(1.4)
Ал, салыстырмалы молекулалық масса зат молекуласының орташа массасының атомдық масса бірлігіне неше еселі екендігін көрсететін шама:
Mr(зат) =  |М| = Mr (1.5)
|М| = Mr (1.5)
Заттың салыстырмалы молекулалық массасы оның құрамына кіретін атомдардың салыстырмалы атомдық массаларының қосындысына тең болады:
Mr(CхВу) = хAr(C) + уAr (В)
Мольдік көлем – газ көлемінің зат мөлшеріне қатынасымен анықталады.
 =
= 

 (1.6)
(1.6)
Қалыпты жағдайда (t =О 0С, Т = 273 К, р = 1 атм = 101,3 кПа) кез келген газдың 1 молі 22,4 л көлем алады, оны мольдік көлем деп атайды.
 2017-12-14
2017-12-14 3335
3335







