Иондар арасындағы күштердің әрекеттесуі ерітіндінің электрөткізгіштігінің төмендеуіне, қату және қайнау температурасына, иондардың химиялық реакцияларға түсу қабілетіне әсер етеді. Сондықтан, дәлірек есептеу үшін тепе–теңдік концентрациясының орнына активтілік пайдаланылады. Активтілік иондардың өзара тартылысын, еріген заттардың еріткіштермен әреккеттесуін, өзге иондардың қатысуын және басқа да иондардың ерітіндідегі қозғалысын өзгертетін құбылыстарды есепке алады. Иондардың активтілігі деп, химиялық реакциялар кезінде тиімді әрекеттесетін концентрациясын айтамыз. Активтілік химиялық реакциялар кезінде бұл иондар, олардың концентрациясы 0,1 г-ион/л тең болғандағыдай емес, 0,0814 г-ион/л тең болғандағыдай әрекет етеді. Активтілік мольмен және бір литрдегі г-ионмен есептеледі. Шексіз сұйытылған ерітінділер үшін а-С, яғни иондар арасындағы күштердің иондардың қозғалысына әсер етуі аз. Активтіліктің шын мәніндегі концентрациядан қанша есе көп екендігін көрсететін шаманы активтілік коэффициенті деп атайды:
F= 
Шексіз сұйылтқанда а = С, ал активтілік коэффиценті. Жоғарыда көрсетілген теңдеуден активтілік, активтілік коэффиценттерінің концентрацияға көбейтіндісіне тең болады. Қайтымды реакциялар үшін активтілік шамасын концентрация орнына қойса, төмендегідей теңдеу пайда болады:
A+B=C+D
K= 
Активтілік арқылы анықталатын электролиттік диссоциация константасына шын немесе термодинамикалық электролиттік диссоциация константасы деп атайды. Дегенмен иондардың активтілік коэффиценті тек қана берілген электролиттің концентрациясына ғана байланысты емес, сонымен қатар ерітіндіде болатын басқа да иондардың концентрациясына байланысты болады. Ерітіндідегі иондар арасындағы электростатикалық әрекеттесудің өлшемі ерітіндінің иондық күші болып табылады ( ). Ерітіндінің иондық күші ерітіндідегі барлық иондардың концентрациясының олардың зарядының квадратының көбейтіндісінің жартысына тең:
). Ерітіндінің иондық күші ерітіндідегі барлық иондардың концентрациясының олардың зарядының квадратының көбейтіндісінің жартысына тең:
 =
=  (C1Z12+C2Z22+…CnZn2)
(C1Z12+C2Z22+…CnZn2)
Қысқартылған түрі былай болады:
 =
= 
 C
C  *Z
*Z  2
2
Ерітіндінің иондық күшімен иондардың активтілік коэффиценттерінің арасындағы байланысты Дебай мен Хюккельдің формуласы көрсетеді.
Өте сұйытылған ерітінділер үшін: (0,01-0,05 H)
-lg=0,5Z2 
Күштірек концентрленген (аздап қоюланған) ерітінділер үшін: (0,1-0,5 H)
-lg=0,5Z 
Ерітіндегі барлық иондардың концентрациялары мен зарядтарына байланысты болатын ерітіндінің иондық күші өскен сайын активтілік күшінің шамасы түседі. Жоғарыдағы көрсетілген формулаларды пайдалана отырып әр-түрлі ерітінділердің иондық күшін, активтілігін және активтілік коэффицентін анықтауға болады.
Мысал
0,1 M NaCl eрітіндісіндегі Na+ және Cl- иондардың иондық күші мен активтілігін есептеп тап.
1) Осы тұздың судағы ерітіндісінің электролиттік диссоциация теңдеуін құрамыз:
NaCl 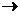 Na++CI-
Na++CI-
Na+ және Cl- иондардың молярлық концентрациялары 1 моль/л болады.
2) Ерітіндінің иондық күшін есептейміз:
 =
=  (12∙Na- + 12 ∙ CСI-) =
(12∙Na- + 12 ∙ CСI-) =  (1 ∙ 0,01+1 ∙0,01) = 0,01
(1 ∙ 0,01+1 ∙0,01) = 0,01
3) Кесте бойынша активтілік коэффицентінің орташа мәнін табамыз. Бір зарядты иондар үшін  Формула бойынша a =
Формула бойынша a =  олай болса:
олай болса:
Acl = aNa+ = 0,89 ∙ 0,01 = 8,9 ∙10-3 моль/л
Ерітіндінің әртүрлі иондық күші кезіндегі активтілік коэффицентінің жуық мәндері
| Әртүрлі зарядты иондар үшін мәні | Ерітіндінің иондық күші  г-ион/моль г-ион/моль | ||||||||
| 0,0005 | 0,001 | 0,0025 | 0,005 | 0,01 | 0,025 | 0,05 | 0,1 | 0,2 | |
| 0,975 | 0,904 | 0,945 | 0,925 | 0,900 | 0,655 | 0,81 | 0,76 | 0,70 | |
| 0,903 | 0,870 | 0,105 | 0,742 | 0,67 | 0,55 | 0,45 | 0,37 | 0,24 | |
| 0,802 | 0,73 | 0,64 | 0,51 | 0,44 | 0,32 | 0,24 | 0,18 | 0,24 | |
| 0,678 | 0,58 | 0,45 | 0,35 | 0,25 | 0,15 | 0,10 | 0,06 | 0,08 | |
| Н+ | 0,975 | 0,97 | 0,95 | 0,93 | 0,91 | 0,88 | 0,86 | 0,83 | 0,76 |
| ОН- | 0,975 | 0,964 | 0,946 | 0,926 | 0,90 | 0,85 | 0,81 | 0,76 | 0,70 |
Мысал
0,005 м ZnSО4 және 0,01 м AlCl3-тен тұратын ерітіндіден SO42- сульфат ионының иондық күші мен активтілігін тап.
1) Ерітіндідегі барлық иондарды есепке ала отырып ерітіндінің иондық күшін табамыз:
ZnSO4  Zn2++SO42-
Zn2++SO42-
AlCl3  Al3++3Cl-
Al3++3Cl-
Ол үшін осы иондардың молярлық концентрацияларын табамыз:
C (Zn2+) = 1∙ 0,005 =0,005 моль/л
C (SO4-2) = 1 ∙ 0,005 =0,005 моль/л
C(AI3+) = 1 ∙ 0,01=0,01 моль/л
C(CI-) = 3 ∙ 0,01=0,003 моль/л
f-ті кесте бойынша табамыз:2 зарядты иондар үшін  = 0,47
= 0,47
C (SO4-2) = C (SO4-2) ∙ fso42- = 0,005 ∙ 0,47 = 0,00235 = 2,35 ∙103- моль/л
Суда нашар еритін электролиттердің диссоциация.
Ерігіштік көбейтіндісі
Қатты заттардың судағы ерігіштігі әртүрлі (ерігіштік кестесіне қараңыз). Суда нашар ериді дейтін электролиттің өзі де аз да болса полюсті су молекуласы әсерінен иондарға ыдырайды. Соның нәтижесінде суда нашар еритін зат пен ерітіндідегі иондар арасында тепе-теңдік орнайды.

олай болса, оның тепе-теңдік константасы:
 (11)
(11)

 (12)
(12)
Температура тұрақты болғанда суда нашар еритін электролиттің қанық ерітіндісіндегі иондар концентрацияларының көбейтіндісі тұрақты шама болады, оны осы заттың ерігіштік көбейтіндісі деп атайды.
Енді осыны нақты заттар үшін қарастырсақ:

Заттардың ерігіштік көбейтіндісінің мәні оның судағы ерігіштігін сипаттайды. Бір типтес заттар үшін қайсысының ерігіштік көбейтіндісінің мәні үлкен болса, соның ерігіштігі де үлкен болады.

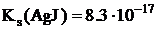
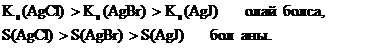
Заттардың ерігіштігіне ерітіндідегі аттас иондардың және кешенді қосылыс түзушінің болуы әсер етеді. Заттың ерігіштік көбейтіндісінің мәні бойынша оның ерігіштігін, ал ерігіштігі бойынша ерігіштік көбейтіндісін есептеуге болады және тұнбаның түсу және еру шарттарын анықтауға болады.
Тұнбаның түсу және еру шарттары.
Барий сульфатының қанық (BaSO4) ерітіндісіне натрий сульфатының ерітіндісін қосқанда не байқалады, соны қарастырайық.
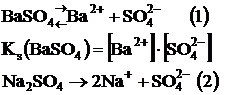
Заттардың диссоциациялану теңдеуі бо йынша ерітіндіде аттас SO42- ионының концентрациясының артуына байланысты 1-тепе-теңдік Ле-Шателье принципі бойынша солға ығысатыны көрініп тұр, яғни тұнба мөлшері артатын жаққа. Сондықтан ерігіштік көбейтіндісіндегі теңдік теңсіздікке өзгереді.
 (13)
(13)
міне осы тұнба түсу шарты болып есептеледі.
Енді кальций карбонатының қанық ерітіндісіне тұз қышқылының ерітіндісін құйғанда заттың ерігіштік көбейтіндісіне қандай өзгеріс енуі мүмкін, мінеки осыны қарастырайық.

Қышқылдың диссоциациялануынан түзілген сутек иондары тұздың карбонат иондарын қосып CO2-ге айналады:
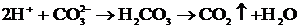
Сонда, тепе-теңдік (3) солға қарай ығысады, яғни зат ериді, бұл жағдайда да ерігіштік көбейтіндісіндегі теңдік мынандай теңсіздікке айналады:
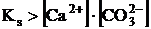 (14)
(14)
міне осы шарт тұнбаның еру шарты болып саналады.
Бұдан мынандай қорытынды жасауға болады: егер иондар концентрацияларының көбейтіндісі ерігіштік көбейтіндісінің мәнінен үлкен болса, тұнба мөлшері артады, ал кіші болса, тұнба ериді.
Ерітіндідегі ион алмасу реакциялары
Диссоциация теориясының бір қағидасы бойынша электролит ерітінділерінің химиялық қасиеті ондағы иондар табиғатымен анықталады. Олай болса, ерітіндідегі реакцияларды иондар арасында жүретін әрекет деп қарастыруға болады.
Реакциялар аяғына дейін жүру үшін үш шарт орындалуы тиіс:тұнба түсу, газ бөліну немесе әлсіз электролит түзілу (Бертолле ережесі).
Осы шарттарға сай реакция теңдеулерін қарастырайық, ол үшін алдымен реакцияның толық молекулалық теңдеуін құрып алып, оның иондық теңдеуін жазып, соңынан оның қысқартылған иондық теңдеуі құрылады.
Тұнба түсе жүретін реакция
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
 2
2Na+ + CO3 2- + Ca 2+ 2OH- = CaCO3 + 2Na+2OH-
CO32- + Ca2+ = CaCO3
Газ түзе жүретін реакция:
 CO2
CO2
 Na2CO3 + 2HCl = 2NaCl + H2CO3 H2O
Na2CO3 + 2HCl = 2NaCl + H2CO3 H2O
 2
2Na+CO32- + 2H+2Cl- = 2Na+2Cl- + H2O + CO2
CO32- + 2H+ = H2O + CO2↑
Әлсіз электролит түзе жүретін реакция
KOH + HNO3 = KNO3 + H2O

K+OH- + H+NO3- = K+NO3- + H2O
ОH- + H+ = H2O
Сонда осы шарт бойынша мына төменде келтірілген реакциялардың аяғына дейін жүрмейтіндігін алдын-ала болжауға болады:
а)  б)
б) 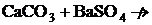
ә)  в)
в) 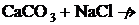
Нашар еритін электролиттердің ерігіштігіне бір аттас иондардың әсері
Кез келген еритін қосылыс абсолютті ерімейтін болып табылмайды. Неғұрлым ЕК төмен болса, соғұрлым берілген қосылыс қиын еритін болады. Күміс нитратының ерітіндісіне тұз қышқылын калий хлориді ерітіндісінің эквивалентті мөлшерін құямыз, бұл кезде аргентум хлориді ақ тұнбасы пайда болады, бірақ ерігіштік көбейтіндісіне тең. Аргентум, хлор иондарының бір бөлшегі тұнбаға түспей ерітіндіде қалып қойды:
Е = [Ag+] = [CI-] = 
Қаныққан ерітіндіде [CI-] артық мөлшері [CI-] концентрациясынан бір шама артық болғандықтан, [CI-] ионының концентрациясын еске алмай қоюға болады да жоғарыда жазылған теңдеудегі төмендегідей түрге айналдыруға болады.
ЕAgCI = [CI-] = 
Егер аргентум нитраттың ерітіндісінің артық мөлшері құйылған болса, онда аргентум бір аттас ион болып табылады.
ЕAgCI = [CI-] = 
Бұл жағдайда ЕКAgC I мына теңдеу бойынша анықталады:
ЕКAgCI = ([Ag+] + [Ag+] артық мөлшері) ∙ [CI-]
Сонымен, тұндырғыш реактивтің артық мөлшерін қосқан кезде тұнбаның ерігіштігі төмендейді және тұнба түзетін иондарының біреуімен аттас иондардың артық мөлшеріне байланысты болады.
Тұздық әсер
Нашар еритін тұздардың ерігіштігіне тек қана олармен біртектес иондары бар электролиттер ғана әсер етіп қоймайды, сонымен қатар біртектес иондары жоқ электролиттер де әсер етеді. Кейбір нашар еритін тұздардың ерігіштігі басқа жақсы еритін, бірақ тұнбамен ешқандай біртектес иондары жоқ электролиттердің әсерінен де артады.
Мысалы Қорғасын сульфатының ерігіштігі натрий нитраты соғұрлым және калий нитратты әсерінен артады, неғұрлым бұл тұздардың концентрациялары жоғары болса, қорғасын сульфаты тұзының ерігіштігі арта түседі.
Бұл құбылыс тұздық әсер деп аталады. Өзге иондарды қосқан кездегі ерігіштіктің артуын ерітіндінің иондық күшінің жоғарлауымен түсіндіруге болады  =
= 
 Ci
Ci  Zi2
Zi2
Дебай мен Гюнкельдің теңдеуі бойынша -lg=0,5∙Z2 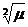 электролиттерді қосқан кезде активтілік коэффициенттерінің төмендейтінін көруге болады.
электролиттерді қосқан кезде активтілік коэффициенттерінің төмендейтінін көруге болады.
АККnAn = akt∙ aAn = [Kt]∙[An]∙fkt ∙fAn, [Kt]∙[An] = 
Бұл теңдеуден активтілік коэффициентінің төмендеуі ерітіндіде Kt және An концентрацияларының өсуіне әкеліп соғатынын көруге болады. Әртүрлі электролиттер нашар еритін тұздардың ерігіштігіне әртүрлі әсер етеді, себебі ерітіндінің иондық күші тек қана тұздардың концентрациясына ғана емес, сонымен қатар иондардың зарядтарының шамасына да байланысты.
СУДЫҢ ИОНДЫҚ КӨБЕЙТІНДІСІ
Судың диссоциациясы, сутектік көрсеткіш
Судың көптеген электролитке еріткіш болғанымен қатар ол нағыз амфолитке мысал бола алады, өйткені ол мынадай иондарға ыдырайды:
 (15)
(15)
Диссоциациялану константасы:

Су әлсіз электролит болуына байланысты диссоциациялану константасының бөліміндегі [H2O] – диссоцияланбаған су концентрациясын көлемі 1л судағы мольдер санымен алу қабылданылған.
V(H2O) = 1л, ρ = 1 г/мл, m(H2O) = 1000г, M(H2O) = 18 г/моль, олай болса ері:

Сонда,  , яғни
, яғни 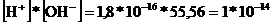
Бұл тұрақты санды су иондарының көбейтіндісі (Кw) деп атайды.
Кw = 1*10-14 = [H+]*[OH-] (8.11)
Суға сілті, қышқыл, тұз ерітінділерін құю Ле-Шателье принципі бойынша (8.10) тепе-теңдікті ығыстырады, бірақ иондар концентрацияларының көбейтіндісі тұрақты болып қалады (тұрақты температурада). Сондықтан ерітіндідегі бір ионның концентрациясы белгілі болса, екіншісінікін анықтау мүмкін болады:


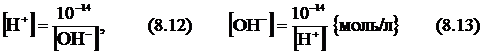
Ерітіндідегі заттың ортасын сандық жағынан осы иондар концентрациясының біреуімен белгілеуге болады, олай болса,
бейтарап ортада: 
қышқылдық ортада: 
ал, сілтілік ортада: 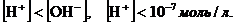 болады.
болады.
Электролиттің судағы ерітіндісінің ортасын белгілеу үшін сутектік көрсеткіш (1920, В.Соренсен) дейтін шама енгізілген (pH).
Сутектік көрсеткіш дегеніміз теріс таңбамен алынған сутек иондарының концентрациясының ондық логарифмі:
 (16)
(16)
Сонда, pH=7 – орта бейтарап, pH<7 – орта қышқылдық, pH>7 – орта сілтілік.
Электролит ерітіндісінің ортасын зертханаларда қарапайым индикаторлар және pH-метрлер көмегімен анықтайды.
Индикаторлар деп электролит ерітінділеріне қосылғанда түстерін өзгертетін әлсіз органикалық қышқылдар не негіздерді айтады.
Мысалы, фенолфталин әлсіз органикалық қышқыл (HJnd), оның диссоциалану теңдеуін жазсақ:
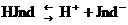
Түссіз таңқұрай

Егер ерітіндіге сілті ерітіндісін құйсақ, тепе-теңдік оңға ығысады, өйткені индикатордың H+ ионымен электролиттің ОH- иондары бірігіп, әлсіз электролит су түзеді, ерітінді түсі таңқурай түсіне боялады. Ал, қышқылдық ортаны анықтау үшін әлсіз органикалық негіздерді пайдаланады.

Сапалық анализ талдау барысында ерітіндісінің рН-ың индикатор арқылы анықтайды. Индикаторлар ортаның рН-на байланысты өзінің түзіп өзгеретін заттар.
Мысал
Сутек ионының концентрациясы [H+]=3 ∙10-5 моль/л болғанда ерітіндінің рН және рОН-ын
есептеу.
ШЕШУІ:
рН = -lg[H+] = -lg(3 ∙10-5) = -(lg3 ∙ lg10-3) = -(lg3-5lg10) = -(0,48 -5) = 5 – 0,48 = 4,52
pOH = 14-pH = 14 – 4,52 = 9,48
Ендеше, ерітінді реакциясы қышқылды болады екен.
Күшті қышқылдар мен негіздер ерітінділеріндегі рН-тың есептеп шығарылуы
Күшті қышқылдардың (HCl,HBr,HJ,H2SO4,HNO3,HClO3,HClO4, және т.б) сулы ерітінділері 100% диссоциациялануына байланысты, сутек иондардың концентрациясы қышқыл концентраиясын тең болады.
[H+] = C қышқыл, рН = -lg C қышқыл
Күшті негіздер де осыған сәйкес: [OH-] = Cнегіз; pOH = -lgCнегіз
[H+]=  Сонда, pH = -lg
Сонда, pH = -lg 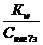 = lgKw + lgCнегіз
= lgKw + lgCнегіз
содан, рН=14 –pOH
Әлсіз қышқылдар мен негіздер ерітінділеріндегі рН-ың шығарылуы
Әлсіз қышқылдар мен әлсіз негіздердің, күшті қышқылдар мен күшті негіздердін айырмашылығы сулы ерітіндіде өте аз мөлшерде диссоциацияланатындығында, сондықтан бұлардағы рН-ты диссоциация константасын ескере отырып есептеп шығарады.
Әлсіз қышқылдар үшін: HAn ↔ H+ + An- , Kқышқыл= 
[H+] = [An-] концентраиялары бір негізді қышқылдар үшін тең болғандықтан, тепе-теңдігі басқа түрде жазуға болады,ол: Kқышқыл=  , бұдан, [ H+]=
, бұдан, [ H+]= 
демек, рН= -  lg Kқышқыл -
lg Kқышқыл -  lgCқышқыл немесе рН=
lgCқышқыл немесе рН= 
Әлсіз негіздер үшін: KtOH- → Kt+ + OH-, Kнегіз= 
[OH]=  , pOH = -
, pOH = -  lg Kнегіз-
lg Kнегіз-  lg Cнегіз =
lg Cнегіз =  pKнег -
pKнег -  lgCнег
lgCнег
pH = 14 - pOH
Әлсіз көп негіздері қышқыл ерітінділеріндегі рН-ты есептеу
Көп негізді қышқылдардың сулы ерітіңділерінің диссоциациясы бірнеше сатыда өтеді.
Егер бірінші сатыдағы қышқылдың ионизациялану константасы шамамен 2-ші сатыға қарағанда 1000 есе артық болса, онда тек 2–ші сатыдағы ионизациялану ғана есепке алынады, себебі сутек иондарының концентрациясы негізінен 1-ші сатыдағы ионизациялану дәрежесімен анықталады. Мысалы, көмір қышқылының ионизациясы 2 сатыда жүреді:
I 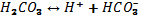 (I саты)
(I саты)
II 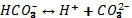 (II саты)
(II саты)

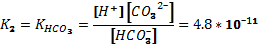
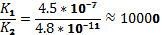
Сонымен, 0,01 м көмір қышқылы ерітіндісіндегі 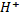 концентрациясы
концентрациясы  есепке ала отырып анықталады:
есепке ала отырып анықталады:
[H+] =  = 6,7 ∙ 10-5
= 6,7 ∙ 10-5
Буферлік ерітінділер
Егер кез келген қышқылдың немесе сілтінің ерітіндісіне суды қосса, онда сутек немесе гидроксид иондарының концентрациясы да азаяды.
Мысалы HCI тұз қышқылын 0,01 н 10-ға сұйылтсақ, онда оның концентрациясы 0,001 Н-ға тең болады, яғни 10 есе азаяды, осыған байланысты ерітіндідегі рН 2- 3-ке дейін өзгереді. Егер суды әлсіз қышқыл қоспасы СH3COOH және оның тұзы СH3OONa немесе әлсіз негіз NH2OH және NH2 құйсақ, онда ерітіндінің сұйылуына қарамастан сутегі және гидроксил иондарының концентрациясы, демек ерітіндідегі рН өзгеріссіз қалады. Ерітінділерді сұйылтып және оған қышқылмен негіздің аз мөлшерін қосқан кезде оның рН-тың мәнін сақтап қалу қасиетін буферлік әрекет деп атайды. Ал бір мезгіл кезінде әлсіз қышқыл және оның тұзы немесе әлсіз негіз және оның тұзы бар, буферлік әрекет жасаушы ерітінділерді буферлік ерітінділер деп атайды. Осындай буферлік ерітінділерге жататын қоспалары:
ацетатты буфер – CH3COOH+CH3COONa
аммиакты буфер NH4OH+NH4Cl,
карбонатты буфер NaH2CO3
фосфатты буфер NaH2PO4+Na2HPO4 .
Буферлі әрекеттің мәні
Буферлік жүйелердің оларға аз мөлшерде күшті қышқыл немесе күшті негіз қосқан кезде рН-ты тұрақты ұстау қасиеті буферлік қоспа құрамының бір бөлігі қосылған қышқылдың – иондарымен әрекеттесуіне негізделген.
Мысалы егер ацетатты буферлік ерітіндіге күшті қышқыл құйса, онда ацетат – ион және қышқылдың сутек иондары арасында реакция жүреді:
CH3COONa+HCl  CH3COOH+NaCl
CH3COOH+NaCl
немесе
CH3COO- +H-  CH3COOH
CH3COOH
Сондай-ақ күшті қышқылдың орнына диссоциацияға аз түсетін сірке қышқылы басады және ерітіндідегі рН өзгеріске ұшырамайды. Ацетатты буферлі қоспаға күшті негіз қосқан кезде буферлік қоспаның екінші (құрамдық бөлігі) компоненті болып табылатын сірке қышқылымен бұл негіз бейтараптанады (нейтралданады):
CH3COOH+NaOH  CH3COONa+H2O
CH3COONa+H2O
немесе
H+ +OH-  H2O
H2O
Екі жағдайда да ерітіндідегі [H+] және [OH-] концентрациясы айтарлықтай өзгере қоймады, яғни күшті электролиттер аз диссоциацияланатын әлсіз электролиттермен байланысады да сондықтан ортаның рН- ы өзгермейді. Буферлік ерітінділердің ерітіндідегі рН- ты тұрақты ұстап тұру шексіз тұрақты емес, ол буферлік ерітіндінің сапасы мен компоненттердің концентрациясына байланысты болады, буферлік сыйымдылық деген ұғым енгізілді.
Буферлік сыйымдылық деген не Бір литр буферлік ерітіндіге қышқыл немесе негіз қосқанда оның рН мәні тек бірге ғана өзгерте алатын қышқыл мен негіздің шекті мөлшерін айтады.
 2017-12-14
2017-12-14 8652
8652








