Лабораторная работа «Определение коэффициента распределения бензойной кислоты в системе вода – органический растворитель (изобутанол)»
Теоретическая часть.
Если к двум несмешивающимся жидкостям прибавить небольшое количество третьего компонента, то после установления равновесия он окажется в той или иной степени присутствующим в обоих слоях, при этом между двумя жидкостями третий компонент окажется распределенным в строго определенных соотношениях.
Для каждой рассматриваемой температуры отношение концентраций третьего компонента в двух равновесных жидких фазах является величиной постоянной при различных его концентрациях.
Закон распределения выводится термодинамическим путём. В процессе распределения третьего компонента между двумя нерастворимыми жидкостями условием равновесия является равенство химических потенциалов этого компонента в обеих фазах:  .
.
Химический потенциал вещества в растворе выражается формулой  .
.
Тогда при равенстве химического потенциала распределяемого компонента в первом и во втором растворах получим:
 (1)
(1)
где mi0(I ), mi0(II ) – стандартные химические потенциалы компонента в первом и втором растворах (при активностях ai(I )= 1, ai(II )= 1, соответственно); ai(I ), ai(II ) – активности компонента i в первом и втором растворах.
Отсюда
 . (2)
. (2)
Т.к. при постоянной температуре все члены в правой части уравнения постоянны.
Следовательно, при постоянной температуре отношение активностей есть величина постоянная:
 (3)
(3)
Величина Ко называется термодинамической константой распределения. Уравнение (3) показывает, что термодинамическая константа распределения не зависит от активностей распределяемого вещества в обоих растворителях, так как при изменении активности компонента в одном растворе изменится активность этого компонента и в другом растворе системы, а их отношение при данной температуре сохранится.
Уравнение закона распределения с учетом выражения для активностей компонента (4) можно записать в иной форме:

, (4)
где К – коэффициент распределения:
 . (5)
. (5)
Для разбавленных растворов (сi(I) ® 0, сi(II) ® 0) коэффициенты активности gi(II) ®1и gi(I) ®1,
тогда:
 . (6)
. (6)
Коэффициент распределения, а, в общем случае, термодинамическая константа распределения зависят от природы распределяемого вещества, природы растворителей (фаз) и от температуры (Т).
Если распределяемое вещество ассоциирует или диссоциирует в растворителях, то в случае образования разбавленных растворов закон распределения может быть записан в следующей форме:
 , (7)
, (7)
где n - величина, постоянная для данной системы при постоянной температуре, определяемая соотношением:
 (8)
(8)
где М1 и М2 - молекулярные массы распределяемого вещества, соответственно, в первом и втором растворителях.
Для разбавленных растворов справедливо соотношение:
 , (9)
, (9)
где a1 и a2 – степени диссоциации или ассоциации распределенного вещества, соответственно, в первой и второй фазах.
Все отклонения от законов идеальных растворов формально учитываются коэффициентами активности. Поэтому, если известны активности распределяемого компонента в двух растворителях, то уравнением (9) можно пользоваться также и при наличии диссоциации или ассоциации молекул в растворе.
Закон распределения относится не только к распределению вещества между двумя жидкостями, но имеет более общий характер. Так, известный закон Генри является частным случаем рассматриваемого закона и описывает распределение вещества между газом и жидкостью:
 (10)
(10)
где КГ – константа Генри; Р – парциальное давление газа над жидкостью;
с – концентрация газа в насыщенном растворе (растворимость).
Закон справедлив и в случае распределения вещества между контактирующими твердой и жидкой фазами при наступлении состояния равновесия. В последнем случае закон распределения имеет вид:
 (11)
(11)
где Ciтв и Ciж - концентрации распределяемого вещества в твердой и жидкой фазах при равновесии.
Закон распределения имеет важное теоретическое и практическое значение. С использованием этого закона можно определять степень диссоциации и ассоциации растворенного вещества в том или ином растворителе; активности и коэффициенты активности веществ; константы равновесия химических реакций, протекающих в одной из фаз, и другие величины. Этот закон обосновывает один из важнейших препаративных и технологических процессов – экстракцию.
Экстракция – извлечение растворенного вещества из раствора при помощи другого растворителя (экстрагента), практически не смешивающегося с исходным раствором.
Экстракция широко применяется в лабораториях и производстве для выделения в более концентрированном состоянии какой-либо составной части раствора или для удаления нежелательной составной части (очистки) исходного раствора. Экстракция может быть однократной или многоступенчатой (с применением на каждой ступени свежей порции растворителя – экстрагента). Схема одноступенчатой экстракции приведена на рис.
| Исходный раствор go; V1 |
| Экстрагент V2 |
| Экстракция при перемешивании до наступления равновесия |
| Разделение фаз |
| Рафинат g1; V1 c1 = g1/V1 |
| Экстракт go – g1; V2 с2 = (go – g1)/ V2 |
Рис.1Схема экстракции
При одноступенчатой экстракции исходный раствор, содержащий извлекаемое вещество, перемешивается до наступления равновесия с экстрагентом. После отстаивания экстрагент с извлеченным веществом (экстракт) отделяется от раствора с оставшимся количеством растворенного вещества (рафината).
На основании закона распределения можно рассчитать количество вещества gn, которое остается в растворе после n экстракций одинаковым объемом экстрагента. Если пренебречь изменениями объемов несмешивающихся растворов, то при установлении равновесия для первой ступени экстракции для разбавленных растворов при отсутствии диссоциации или ассоциации имеем:
 (12)
(12)
где go – количество извлекаемого вещества в исходном растворе;
g1 – количество извлекаемого вещества, оставшегося в растворе (рафинате) после однократной экстракции;
(go-g1) – количество вещества, перешедшее в экстрагент при равновесии;
V1 – объем раствора, из которого извлекается вещество;
V2 –объем экстрагента.
Из выражения (19) количество вещества, оставшегося в исходном растворе после однократной экстракции, может быть рассчитано по формуле:
 (13)
(13)
Для второй ступени экстракции таким же объемом V2 свежей порцией растворителя при равновесии между экстрактом и рафинатом можно записать
 (14)
(14)
где с′1 и с′2 – концентрации распределяемого вещества в экстракте и рафинате после второй ступени экстракции в состоянии равновесия;
g2 – количество вещества, оставшегося в рафинате после второй ступени экстракции,
отсюда
 (15)
(15)
Учитывая выражение (20) для величины g1, получим
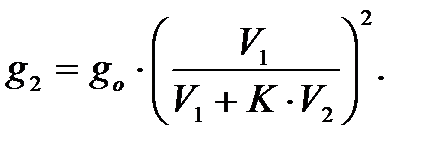 (16)
(16)
Можно показать, что количество вещества, оставшегосяв растворе после n экстракций, составляет:
 (17)
(17)
Из полученного уравнения следует, что большей эффективности экстракции (меньшему gn) соответствуют больший объем экстрагента V2,больший коэффициент распределения К и увеличение числа экстракций n (n определяет показатель степени дроби, которая меньше 1).
Общее количество вещества, извлеченного при экстрагировании (gЭ):
gЭ = go – gn, (18)
или
 (19)
(19)
При однократном экстрагировании одним общим объемом nV2 в растворе в соответствии с формулой (20) остается следующее количество вещества:
 (20)
(20)
Анализ уравнений показывает, что многократное экстрагирование порциями растворителя более эффективно, чем однократное экстрагирование общим объемом экстрагента – растворителя. Это связано с тем, что при каждой новой экстракции раствор с извлекаемым веществом приводится в контакт со свежей порцией экстрагента. В химической технологии многократную экстракцию заменяют экстракцией в противотоке, что обеспечивает эффективное извлечение веществ из растворов.
При жидкостной экстракции коэффициентом распределения условились называть отношения концентрации вещества в экстракте к его концентрации в рафинате. Величины коэффициентов распределения приводятся в справочниках.
Наиболее часто встречается извлечение веществ из водных растворов с помощью органических растворителей, мало растворимых в воде. Если в водном растворе экстрагируемое вещество частично диссоциирует, то перед экстракцией его диссоциацию подавляют добавлением электролита с одноименным ионом. Увеличение содержания недиссоциированных молекул в водной фазе способствует переходу вещества в органическую фазу. Для увеличения полноты извлечения экстрагируемого вещества из водной фазы также понижают его растворимость в воде, прибавляя к водному раствору соли (высаливание).
В рассматриваемой ниже лабораторной работе в предлагаемых для эксперимента органических растворителях бензойная кислота имеет неизменную молекулярную массу (не диссоциирует и не ассоциирует), а её диссоциацией в водном слое пренебрегают.
При проведении экспериментов используют растворы кислоты малой концентрации, поэтому закон распределения применяют в следующей форме:
 (21)
(21)
где К – коэффициент распределения уксусной кислоты между данными фазами при температуре эксперимента (комнатной);
скорг. – концентрация кислоты в органической фазе в состоянии равновесия,моль/л;
скводн. – концентрация кислоты в водной фазе в состоянии равновесия, моль/л.
 2017-12-14
2017-12-14 2008
2008







