1. Классификация механизмов адсорбции. Природа адсорбционных сил и их особенности при физической адсорбции. Вывод уравнения для энергии дисперсионного взаимодействия атома адсорбата с адсорбентом. Изотерма, изостера, изопикна адсорбции.
Процессы адсорбции классифицируют в соответствии с типом взаимодействия адсорбата с адсорбентом. Физико-химическая классификация основывается на том положении, что перераспределение компонентов между объемной фазой и поверхностным слоем может происходить под действием физических сил или в результате химической реакции между адсорбатом и адсорбентом. Химическую реакцию в этом случае можно представить либо как химическое присоединение атомов (молекул), либо как ионообменное взаимодействие. Таким образом, согласно физико-химической классификации различают физическую (молекулярную) адсорбцию, хемосорбцию (химическое присоединение атома, молекулы) и ионный обмен.
При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей. Эти адсорбционные силы обеспечивают притяжение атомов (молекул); на очень близком расстоянии проявляются короткодействующие силы отталкивания.
При химической адсорбции между адсорбатом и адсорбентом образуется химическая связь, и они теряют индивидуальность.
Для молекул с небольшими дипольными моментами основной вклад в энергию взаимодействия вносят дисперсионные силы. Характерно, что для всех трех составляющих сил Ван-дер-Ваальса выполняется один и тот же закон изменения энергии притяжения от расстояния:  .
.
Так как общая энергия взаимодействия при адсорбции Uадс определяется суммой энергии взаимодействия адсорбированного атома со всеми атомами в объеме адсорбента, то 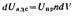
Величину dV можно определить через поверхность шарового сегмента: 
Тогда 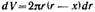
Подставляя, получим:

Проведем интегрирование в пределах расстояния от r = х до r = ∞ и окончательно получим: 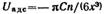
Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой адсорбции.
Зависимость величины адсорбции от температуры прв постоянной концентрации (или парциальном давлении) вещества называется изопикной (или изобарой) адсорбции.
Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой адсорбции.
2. Два вида устойчивости дисперсных систем. Лиофильные и лиофобные системы. Критерий лиофильности и лиофобности по Ребиндеру-Щукину. Термодинамические и кинетические факторы устойчивости дисперсных систем.
По предложению Н. П. Пескова устойчивость дисперсных систем подразделяют на два вида: устойчивость к осаждению дисперсной фазы и устойчивость к агрегации ее частиц. Первый вид устойчивости характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды, или ее устойчивость к разделению фаз ‑ седиментационная устойчивость. Второй вид устойчивости ‑ агрегативная устойчивость (устойчивость к слипанию) дисперсных систем.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы).
Различают термодинамические и кинетические факторы агрегатнвной устойчивости дисперсных систем. Так как движущей силой коагуляции является избыточная поверхностная энергия, то основными факторами, обеспечивающими устойчивость дисперсных систем (при сохранении размера поверхности), будут те, которые снижают поверхностное натяжение. Эти факторы относят к термодинамическим. Они уменьшают вероятность эффективных соударений между частицами, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции.
Кинетические факторы, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды: с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними.
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем:
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3. Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6. Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Условие термодинамической агрегатнвной устойчивости дисперсной системы можно записать так:
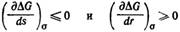
Это означает, что энергия Гиббса не должна увеличиваться с ростом межфазной поверхности (при постоянном межфазном натяжении) или с уменьшением размеров частиц. Межфазная поверхность может самопроизвольно возрастать, только если поверхностная энергия будет компенсироваться увеличением энтропии системы. Такое явление получило название самопроизвольного диспергирования.
Из этих положений следует уравнение самопроизвольного диспергирования Ребиндера-Щукина:  .
.
3. Используя гипсометрический закон, рассчитайте для золя Al2O3 высоту, на которой концентрация частиц уменьшится в е раз. Принять, что форма частиц сферическая, удельная поверхность дисперсной фазы 3·103 м-1, плотность Al2O3 4000 кг/м3, плотность дисперсионной среды 1000 кг/м3, температура 20 ºС.

 2017-12-16
2017-12-16 3754
3754
