Тема 10
Функціональні особливості білків та
Шляхи вирішення білкового харчування в україні
Значення білків у харчуванні людини. Білковий та амінокислотний склад харчових продуктів
У світлі сучасних даних відомі поживні речовини класифікують на три групи:
а) речовини, що мають переважно пластичні властивості. Сюди відносять білки, аміно- і нуклеїнові кислоти, ліпоїди, поліненасичені жирні кислоти, макроелементи тощо.
б) речовини переважно енергетичного призначення – вуглеводи, жири;
в) речовини, що виконують в обмінних процесах переважно роль біологічних каталізаторів – вітаміни, мікроелементи, харчові ферменти, гормони тощо.
Однак треба мати на увазі, що провести різку межу між цими групами не вдається. Відомо, що білки, виконуючи в основному пластичну функцію, у певних умовах можуть бути джерелом енергії, а цілий ряд білкових сполук (нуклеїнові сполуки, ферменти, гормони) є досить активними біокаталізаторами.
Жири, поряд з енергетичними властивостями, виконують пластичні функції, входячи як структурні елементи до складу багатьох клітин.
Мікроелементи й вітаміни, будучи біохімічними каталізаторами, водночас можуть відігравати важливу роль як пластичний матеріал тощо.
Дуже важливо детально вивчити різноманітні значення для організму кожної харчової речовини, що дозволить ближче підійти до питань їхнього науково обґрунтованого нормування та створення нового покоління харчових продуктів оздоровчого призначення.
Білок становить основу будь-якої живої матерії. За визначенням Ф. Енгельса, «життя – це спосіб існування білкових тіл, істотним моментом якого є постійний обмін речовин із довкіллям... Усюди, де ми зустрічаємо життя, ми знаходимо, що воно пов'язане з будь-яким білковим тілом, і тому там, де ми зустрічаємо білкове тіло, яке не розкладається, ми, без сумніву, зустрічаємо явище життя».
Сучасна біохімія, фізіологія й наука про харчування повністю підтверджують висновки Ф. Енгельса. Всі життєві процеси в клітинах і тканинах пов'язані з відповідними перетвореннями протоплазматичних і ядерних білків. Це зумовлюється надзвичайною їхньою реактивністю. Вони здатні взаємодіяти з усіма без винятку речовинами, утворюючи комплексні сполуки, які становлять основу клітин, тканин і рідин організму.
Білки – це складні високомолекулярні азотовмісні сполуки, обов'язковою структурною одиницею яких є амінокислоти. На сьогодні хімікам відомо понад 100 амінокислот. У білках тваринного й людського організму, а також у тканинах рослин, як правило, їх зустрічається всього лише 20. Ці амінокислоти можуть мати різну структуру. Основними з них є:
а) моноамінокарбонові:
|
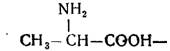
б) моноамінодикарбонові:
 - глютамінова кислота
- глютамінова кислота
в) діаміномонокарбонові:
 - лізин
- лізин
г) оксиамінокислоти:
 - серин
- серин
д) сірковмісні амінокислоти:
|

|

е) амінокислоти циклічного ряду:
|

Таким чином, кожна амінокислота має поряд з певним (ароматичним або неароматичним) радикалом (R) кислотну карбоксильну (-СООН) і основну амінну (-NН2) групи. Тому загальна структурна формула амінокислоти схематично може бути зображена так:
| |||
 | |||
 R
R
Присутність в амінокислотах водночас кислої й лужної груп надає їм можливості сполучатися між собою з утворенням полімерних ланцюгів. Якщо ланцюги короткі, вони називаються пептидами, якщо довгі – поліпептидами.
Пептиди й поліпептиди – це ще не білки. Білки, на відміну від простого поліпептидного ланцюга, мають певну просторову структуру, їхні ланцюги згорнуті в спіралі й клубки. Варто порушити цю складну структуру, розв'язати вузли, розкрутити спіралі – і білок перестає існувати як біологічно активна речовина; утворюється простий поліпептидний ланцюг. Довжина поліпептидних ланцюгів у різних білках може бути різною.
Так, наприклад, білки-гормони – вазопресин і окситоцин – складаються всього з 9 амінокислот, в інсуліні їх 51, у лізоцимі знайдено 124 амінокислотних залишків, у рибонуклеазі – 129, у білку міоглобіні – 153, а в білках сироватки крові – 600…700 амінокислотних залишків тощо.
Потрапляючи із продуктами харчування в травний тракт, білки під впливом травних соків, що містять протеолітичні ферменти (пепсин, трипсин) розпадаються спочатку на менш складні сполуки – альбумози, потім пептони, поліпептиди, дипептиди, а останні – на прості кінцеві продукти – амінокислоти. Амінокислоти, всмоктуючись через кишкові стінки, розносяться кров'ю по тканинах, де знову відбувається синтез специфічних білків організму.
Було показано, що в процесі обміну речовин не всі харчові білки здатні справляти однаковий біологічний ефект. Найбільш високу біологічну активність мають білки тваринних продуктів (м'яса, молока, риби тощо), у першу чергу білок цільного курячого яйця. У білку цільного яйця знайдено найбільш сприятливе для анаболізму співвідношення амінокислот, тобто, як кажуть, він має «ідеальну» амінограму. Висока ефективність яєчного білку зумовлюється також, очевидно, доброю перетравлюваністю й засвоюваністю. Однак яєчний білок не універсальний. Призначений для забезпечення потреб ембріонального розвитку, він не може з таким же успіхом задовольняти потреби дорослого організму; для останнього необхідні інші кількості й співвідношення амінокислот.
Деякі рослинні білки (білок кукурудзи – зеїн, пшениці – гліадин тощо), рідше тваринні (білки желатини, сполучної тканини – еластин, колаген тощо) показали при годівлі експериментальних тварин невисокий біологічний ефект. Додавання до таких білків окремих амінокислот (триптофану, лізину тощо), хоча й підвищує їхню активність, але не доводить її до рівня тваринних продуктів. Отже, ступінь біологічної активності білків їжі зумовлюється передусім її амінокислотним складом.
Серед амінокислот, що складають білки харчових продуктів, були виявлені незамінні (есенціальні) та замінні (неесенціальні) амінокислоти. Незамінні амінокислоти в організмі тварин і людини не здатні синтезуватися, вони повинні надходити до нього в готовому вигляді з їжею. Замінні амінокислоти в організмі утворюються з інших азотовмісних компонентів, головним чином замінних амінокислот. До незамінних відносять вісім амінокислот: валін, ізолейцин, лейцин, лізин, метіонін, треонін, триптофан, фенілаланін.
Для створення оптимальних умов катаболічних процесів у тканинах істотну роль відіграють співвідношення між замінними й незамінними амінокислотами. В експерименті було встановлено, що максимальний біологічний ефект білків їжі може бути досягнуто при загальній кількості азоту – 42% незамінного. Інші 58% повинні припадати на азот замінних амінокислот.
Значення замінних амінокислот їжі зводиться до двох важливих функцій – по-перше, постачання організму матеріалом для синтезу незамінних амінокислот; по-друге, запобігання використання тканинами незамінних амінокислот для синтезу замінних. Детальне вивчення джерел замінного азоту на процеси обміну речовин показало, що не всі вони є рівноцінними. Найбільш ефективним джерелом замінного азоту є глютамінова кислота, потім аспарагінова кислота, аспарагін, аланін, пролін і глютамін (рівнозначні), за ними йдуть амінокислоти гліцин, серин тощо. Набір певних замінних амінокислот як джерело замінного азоту більш ефективне, ніж використання моноамінокислот. При споживанні суміші двох-трьох замінних амінокислот для забезпечення максимального ефекту обов'язкова присутність глютамінової кислоти й гліцину. Важлива також наявність аспарагіну й проліну. Як обов'язкові компоненти в суміші повинні бути деякі вітаміни (В1, В6, фолієва кислота тощо).
В ряді експериментів було показано, що суміші амінокислот, скомпоновані за зразком окремих харчових білків, трохи поступаються за своєю біологічною цінністю природним білкам. Те саме можна сказати про синтетичні амінокислоти порівняно з природними.
При збагаченні раціонів харчування амінокислотами необхідно, щоб усі вони були представлені в певних оптимальних співвідношеннях. Як дефіцит, так і надлишок тієї або іншої амінокислоти в раціоні може призвести до дисбалансу, тобто до порушення рівноваги амінокислот. Явища дисбалансу особливо сильно виявляються в тих випадках, коли до малобілкового раціону додається неповний набір незамінних амінокислот.
Такі раціони негативно позначаються на функції харчування, викликаючи погіршення стану азотистого обміну, зупинку росту молодих організмів, а іноді також жирове переродження печінки тощо.
Наведені дані дозволяють зробити висновок про те, що у випадках недостатнього білкового харчування доцільне збагачення добових раціонів замінними й незамінними амінокислотами. З метою попередження негативного впливу дисбалансу амінокислот необхідно враховувати співвідношення між їхніми окремими представниками. Природні амінокислоти мають перевагу перед синтетичними стосовно активності їхньої біологічної дії.
До теперішнього часу достатньо повно вивчено амінокислотний склад як основних харчових продуктів, так і тканин людського тіла. Це дозволяє складати харчові раціони таким чином, щоб у них всі життєво необхідні амінокислоти перебували в потрібних кількостях і оптимальних поєднаннях. Цьому відповідає харчування, побудоване за принципом максимальної розмаїтості. Одноманітне харчування може викликати дефіцит певних амінокислот, що негативно позначається на стані здоров'я.
Недостатнє надходження білку або окремих амінокислот з їжею призводить до білкової недостатності організму. Під білковою недостатністю розуміють порушення, що виникають в організмі людини в результаті дисбалансу між синтезом і розпадом білку. У дорослої людини цей стан виявляється негативним азотистим балансом і різними змінами з боку окремих систем і органів.
Існує найтісніший взаємозв'язок між білковим і вітамінним обміном. Вітаміни, що надходять в організм з їжею, можуть бути використані тільки за умови їхньої взаємодії з білком. Недостатня або надлишкова (щодо оптимальних норм) кількість білку погіршує засвоєння й порушує фізіологічну роль вітамінів. У першу чергу це виявляється на вітамінах групи В, які є структурними елементами найважливіших окисних систем.
Відзначено також тісний взаємозв'язок між вмістом білку в їжі й кількістю аскорбінової кислоти в тканинах і рідинах тіла. Чим багатша їжа на білок, тим більш насичені тканини аскорбіновою кислотою. Виявилося, що нестача білку викликає інтенсивний розклад аскорбінової кислоти в тканинах. На думку деяких авторів, таке явище зумовлено значним зменшенням в організмі зв'язаної з білком форми вітаміну С, за рахунок збільшення кількості вільної аскорбінової кислоти, що легко окислюється під впливом відповідних ферментів (оксидаз, аскорбіназ тощо).
Явища імунітету й реактивності організму (опірності й чутливості до інфекцій) пов'язані також з особливим станом і перетворенням білків. У світлі сучасних поглядів – утворення антитіл являє собою лише видозмінений процес нормального біосинтезу глобулінів. Тому стан імунітету значною мірою залежить від достатності білкового харчування. Тривала малобілкова дієта може стати однією з головних причин підвищеної чутливості організму людей і тварин до дії різних інфекційних агентів.
Із сказаного випливає, що серйозні порушення стану здоров'я може викликати не тільки дефіцит білка, а й нестача у їжі окремих біологічно важливих амінокислот. Тому харчові раціони різних груп населення повинні містити амінокислоти в оптимальних кількостях і співвідношеннях. Цієї тези необхідно також дотримуватись при створенні нових харчових продуктів, призначених для подолання білкової недостатності.
 2017-12-16
2017-12-16 369
369







