С увеличением температуры скорость газовой коррозии металлов увеличивается и имеет экспоненциальную зависимость (рис.9а). Изменение скорости химической коррозии в зависимости от температуры может быть выражено уравнением Аррениуса:
 (18)
(18)
где А - константа численно равная К при 1 /T = 0,
R = 1,987 кал/моль – газовая постоянная;
е - основание натуральных логарифмов;
Q - энергия активации химической реакции.
Прологарифмировав уравнение (18), получим:
 (19)
(19)
Это уравнение в координатах lg К - 1/T выражается прямой для которой Q = 2,303R tg β; lg А ==lg K при 1/T = 0 (рис. 9б).
 Этот график удобен для определения постоянных А и Q, пользуясь значениями которых можно вычислять для тех же сред отсутствующие значения скорости коррозии при каких-либо температурах.
Этот график удобен для определения постоянных А и Q, пользуясь значениями которых можно вычислять для тех же сред отсутствующие значения скорости коррозии при каких-либо температурах.
|
Газовая коррозия стали и чугуна
Окисление стали
Воздействие кислорода воздуха при высоких температурах на железоуглеродистые сплавы приводит к окислению железа с образованием окалины, обезуглероживанию стали и росту чугуна.
В результате окисления железа при высоких температурах образуется слой продуктов коррозии, называемый окалиной. Окалина имеет сложное строение и включает несколько оксидов: Fe3O4 – магнетит, имеющий сложную кристаллическую решетку шпинели; Fe2O3 – гематит с ромбоэдрической решеткой; FeO – вюстит, обладающий дефектной структурой кристаллической решетки.
Вюстит образуется при температуре выше 575оС и при медленном охлаждении распадается
4FeO  Fe3O4 + Fe.
Fe3O4 + Fe.
Ниже 575оС вюстит в окалине отсутствует и к поверхности стали прилегает непосредственно слой Fe3O4.
Скорость окисления стали с повышением температуры возрастает по закону, близкому к экспоненциальному (рис. 10), и в координатах lgK - 1/T выражается ломаной линией, каждый излом которой соответствует какому-либо превращению.
Так при температуре 575оС в окалине появляется подслой вюстита FeO, не препятствующий диффузии кислорода, в результате чего увеличивается энергия активации процесса и скорость окисления металла увеличивается. Излом кривой при температуре около 900оС соответствует аллотропическому превращению в стали.



Характер изменения температурной зависимости скорости окисления стали указывает на то, что более жаростойкой является аустенитная структура, при которой наблюдается более медленный рост скорости окисления с увеличением температуры.
Состав газовой среды оказывает сильное влияние на скорость окисления стали и чугуна. Если принять скорость коррозии на воздухе при 900оС за 100%, то добавка 2% SO2 увеличивает скорость коррозии стали до 118%, 5% H2O – до 134%, 2% SO2 + 5% H2O до 276%.
Значительное влияние на коррозию стали оказывают продукты горения топлива, содержащего ванадий. При сжигании дешевого, загрязненного ванадием топлива (мазута, погонов нефти) образуется большое количество золы, содержащей V2O5, который является сильным окислителем. Оксид ванадия взаимодействует с защитным слоем окалины на поверхности металла, образуя ванадаты, которые создают с оксидом ванадия V2O5 эвтектики с низкой температурой плавления. Так, ванадат железа FeVO4 имеет температуру плавления 840оС, а температура плавления его эвтектики с V2O5 625оC; температура плавления ванадата хрома CrVO4 - 810оС, а его эвтектики с V2O5 – 665оС. В наибольшей степени ванадиевая коррозия поражает печные змеевики, опоры и перегородки, работающие в интервале температур 620 – 700оС. При этом скорость коррозии даже хромистых и хромоникелевых сталей, не склонных к высокотемпературной сероводородной коррозии достигает 15 мм/год.
Стойкими к ванадиевой коррозии являются высоколегированные сплавы типа Х40Н50. Введение в сталь кремния также оказывает положительное влияние, легирование стали молибденом, вольфрамом, ванадием отрицательно сказывается на стойкости стали, так как эти легирующие элементы промотируют образование V2O5. Сплавы на основе меди весьма подвержены ванадиевой коррозии.
Для снижения скорости ванадиевой коррозии в настоящее время используются следующие мероприятия:
- ограничение рабочей температуры до 650оС;
- использование для изготовления узлов, подверженных этому виду разрушения, сплавов типа Х40Н50;
- вдувание в топливо доломитовой пыли, содержащей оксиды магния и алюминия, которые образуют тугоплавкие соединения с оксидом ванадия;
- ограничение суммарного содержания натрия и ванадия в топливе, не более 2 ×10–4.
При газовой коррозии одновременно с окислением железа происходит обезуглероживание стали
Fe3C +  O2
O2  3Fe
3Fe  + CO,
+ CO,
Fe3C + CO2  3Fe
3Fe  + 2CO,
+ 2CO,
Fe3C + H2O  3Fe
3Fe  + CO + H2.
+ CO + H2.
Из внутренних слоев стали углерод диффундирует к реакционной зоне, и поверхностный слой металла постепенно обедняется улеродом вплоть до полного его исчезновения. Между этим слоем и неизменным составом стали имеется переходный слой с постепенно изменяющимся содержанием углерода. Микроструктура обезуглероженной стали состоит из феррита в наружной зоне, феррита и перлита в переходной зоне и перлита и феррита в сердцевине. Обезуглероживание может заметно влиять на эксплуатационные свойства стали и чугуна: уменьшать поверхностную твердость, стойкость к износу и предел усталости.
Толщина обезуглероженного слоя зависит от состава газовой среды, состава металла, температуры и времени коррозии. Наибольшее обезуглероживание вызывает водяной пар, затем CO2, О2 и воздух. Повышение содержания углерода в стали понижает скорость обезуглероживания вследствие увеличения интенсивности образования оксида углерода. Повышенное содержание в газовой среде СО сильно понижает скорость коррозии. Однако при высоком содержании СО может иметь место науглероживание поверхности стали.
Рост чугуна
Ростом чугуна называется некоторое увеличение размеров чугунных изделий, которое происходит при их переменном нагреве и охлаждении, особенно в области температур феррито – аустенитного превращения. Рост чугуна вызван окислением железа по границам зерен и включениям графита с соответствующим увеличением объема, так как  > 2. Температурные колебания в области фазовых превращений способствуют окислению металла и связанными с этим объемными изменениями, ослабляющими границы зерен и приводящими к ухудшению механических свойств чугунов.
> 2. Температурные колебания в области фазовых превращений способствуют окислению металла и связанными с этим объемными изменениями, ослабляющими границы зерен и приводящими к ухудшению механических свойств чугунов.
Росту чугунов способствуют даже в небольшом количестве компоненты: кремний, алюминий, никель, являющиеся графитизаторами. Однако при высоком содержании никель и кремний оказывают противоположное действие. Так, при высоком содержании никеля склонность чугуна к росту понижается вследствие снижения температуры превращения Fea в Feg и полностью устраняется у аустенитных чугунов. Рост чугунов не наблюдается также при высоком содержании кремния (5 –10%Si) из-за образования на поверхности защитной пленки, состоящей из SiO2.
Методы защиты стали от газовой коррозии
Для защиты стали от газовой коррозии наиболее широкое применение имеют жаростойкое легирование и защитные покрытия.
Основные методы защиты металлов от окисления при высоких температурах основаны на легировании. Сопротивление металлов, окисляемых при высоких температурах, зависит от защитных свойств покрывающей металл оксидной пленки. Основными элементами, способствующими созданию защитного слоя на железоуглеродистых сплавах, являются хром, алюминий и кремний. Эти элементы легче окисляются при высоких температурах на воздухе, чем легируемый металл, и образуют более устойчивую окалину.
Согласно теории жаростойкого легирования, легирующий компонент образует на поверхности металла защитный слой, состоящий только из оксида легирующего компонента. Легирующий элемент должен при этом удовлетворять следующим основным требованиям:
- образующийся на поверхности металла оксид должен быть сплошным, т.е. соотношение  должно быть >1.
должно быть >1.
- оксидный слой должен обладать высоким омическим сопротивлением
RМеО>RFe
- размер ионов легирующего компонента должен быть меньше, чем размер ионов металла основы, т.е. rMe<rFe. Это условие вытекает из следующих соображений:
а) меньший радиус иона легирующего компонента по сравнению с ионом основного металла позволяет предполагать у легирующего компонента больший коэффициент диффузии в сплаве, что может обеспечить преимущественный выход ионов компонента на поверхность сплава и, следовательно, преимущественное образование оксида легирующего компонента;
б) меньший радиус иона легирующего компонента позволит образовать оксид с соответствующими меньшими параметрами, который будет оказывать большое сопротивление диффузии через него и, следовательно, создавать большое затруднение для окисления основного металла. Это подтверждается сравнением размеров ионных радиусов железа и легирующих элементов: хрома, алюминия и кремния
 Ион металла Ион металла | Fe2+ | Cr6+ | Al3+ | Si4+ |
| Ионный радиус, А | 0,74 | 0,52 | 0,50 | 0,41 |
- энергия образования оксида легирующего компонента должна быть больше энергии образования оксида основного металла ΔZMeO<ΔZFeO. Если это условие не соблюдается, то оксид легирующего компонента будет восстанавливаться основным компонентом, как например, оксидная пленка меди не может быть устойчивой на железном сплаве вследствие возможности протекания реакции
CuO+Fe → FeO+Cu
- необходимо соблюдение условий: высокая температура плавления оксида легирующего компонента, низкая упругость диссоциации, а также отсутствие низкоплавких эвтектик в смеси с другими оксидами для того, чтобы оксид легирующего компонента был достаточно устойчив. В качестве примера можно привести элемент бор, который является аналогом Al по таблице Менделеева, но дает легкоплавкие оксиды. Температура плавления ВО3 2940С, и поэтому бор, в отличие от алюминия, не может быть легирующим компонентом, повышающим жаростойкость.
- необходимо образование твердых растворов между легирующими компонентами и основным металлом, так как при этом условии возможно равномерное распределение этого элемента на поверхности и образование сплошной пленки оксида легирующего компонента.
Существует и другая теория, согласно которой легирующий элемент образует на поверхности сплава смешанные оксиды, обладающие повышенными защитными свойствами, по сравнению с оксидами чистых компонентов. Механизм повышения жаростойкости при этом можно свести к тому, что легирующий компонент должен уменьшить возможность образования в окалине на стали вюститной фазы (FeO) и благоприятствовать образованию шпинельной фазы типа Fe3O4ּγFe2O3 с возможно меньшим параметром решетки. Жаростойкие легированные стали имеют на поверхности оксидные слои со структурой именно шпинели. Еще более высокими защитными свойствами обладают сложные шпинели типа FeOּMe2O3 или Fe2O3 ּMeO.
Обе приведенные теории жаростойкого легирования не противоречат, а скорее дополняют друг друга.
Для обеспечения работоспособности при высоких температурах стали должны обладать не только жаростойкостью, но еще и жаропрочностью. Критериями жаропрочности являются предел длительной прочности и сопротовление ползучести.
Не у всех металлов и сплавов имеет место сочетание высокой жаростойкости и жаропрочности. Так, например, алюминиевые сплавы стойки в атмосфере воздуха или топочных газов до температур, близких к температуре плавления, однако они совершенно не жаропрочны. Быстрорежущая вольфрамовая сталь при 600-7000С еще достаточно жаропрочна, но не жаростойка. Удачное сочетание обоих свойств характерно, например, для нержавеющих сталей, для сплавов никеля с хромом (нихром) и др.
Хром, алюминий, кремний интенсивно замедляют окисление железа вследствие образования высокозащитных оксидных пленок, их широко применяют для легирования стали в целях повышения ее жаростойкости. Хром, введенный в сталь, в количествах до 30 %, значительно повышает жаростойкость (табл.3), но высокохромистые стали (Cr>13%) являются ферритными и не поддаются термообработке.
Таблица 3
Влияние хрома на жаростойкость стали
| Процент хрома | Допустимая температура, оС |
Высокохромистые ферритные стали весьма склонны к росту зерна при нагреве выше 800-8500С (особенно после небольшой деформации в холодном состоянии). При длительном нагревании при температурах 485-5000С хромистые стали с нормальным измельчением зерна приобретают тепловую хрупкость, связанную с образованием σ-фазы. Однако вторичный нагрев до температур выше 5000С полностью устраняет эту хрупкость. Стали Х25 и Х28 обладают высокой жаростойкостью при малой жаропрочности, поэтому они применяются для изготовления деталей, работающих при высоких температурах без ударных нагрузок, (насадки форсунок, чехлы термопар, детали топок и др.).
Алюминий и кремний сильнее, чем хром повышают жаростойкость. Однако стали с высоким содержанием алюминия или кремния нетехнологичны. Они хрупки и очень тверды, что затрудняет их обработку. Поэтому сплавы, легированные только кремнием и алюминием не имеют широкого распространения.
Основой для жаростойких сталей является хром, а для дополнительного повышения жаростойкости вводят кремний, алюминий или оба элемента в количествах до 4-5%. Кремний повышает в значительной степени недостаточную у хромистых сталей прочность при высоких температурах.
Стали, легированные хромом и кремнием, известны под названием сильхромов. Они применяются для изготовления теплообменников, пароперегревателей, колосников и т.п.
Наибольшее распространение получили сильхромы марок
Х6С, в котором содержание С < 0,15 1,5-2,0% Si 5,0-6,5 Cr
Х8С, в котором содержание 0,3-0,5%С 2,0-3,0% Si 8,0-10,0% Cr
Указанные сильхромы относятся к мартенситному классу, имеют достаточно высокую вязкость в нагретом состоянии (при температурах от 350 до 8500С), обладают высокими механическими свойствами до температуры 6000С.
Дальнейшее повышение жаростойкости достигается добавочным легированием сильхромов алюминием. Такие сплавы называются сихромалями. Сихромали содержат от 10 до 15% Cr, 1-2% Si, 1,0-2,0% Al.
Большое распространение получила сихромаль марки Х12ЮС, содержащая 0,07-0,12% С, 1,2-2,0% Si, 11,5-14,0% Cr, 1,0-1,8% Al.
Очень высокой жаростойкостью отличаются высокохромистые сплавы со значительным содержанием алюминия: фехраль 12-14% Cr, 4-5% Al, хромаль 30% Cr, 5%Al, канталь 30% Cr, 5% Al, 3% Со. Для изготовления литых заготовок применяют чугун- нирезист, содержащий 28-33% Cr, до 2% С и 3%Si.
Дополнительное введение в жаростойкие стали никеля повышает их жаропрочность. Для этих же целей часто вводят в стали молибден (до 2%) и вольфрам (до 4-6%). Это связано с тем, что эти элементы повышают температуру рекристализации стали и тем самым предотвращают разупрочнение ее при высокой температуре.
С целью экономии легированных сталей жаростойкость углеродистых сталей повышают, применяя защитные покрытия.
Для нанесения на сталь защитных покрытий пользуются следующими методами: термодиффузионным, плакированием, наплавкой. Для нанесения покрытий термодиффузионным методом стальное изделие после очистки поверхности механическим способом и травлением помещают в реакционную смесь, состоящую из порошка наносимого металла и катализатора. Например, при нанесении алюминиевых покрытий смесь содержит измельченный ферроалюминиевый и хлористый аммоний. Процесс насыщения поверхности стали алюминием (алитирование) производится при высоких температурах (900-9500С), в результате чего происходит разложение хлористого аммония на аммиак и хлористый водород:
NH4Cl → NH3 + HCl
Далее происходит реакция
2Al +6HCl → 3H2 + 2AlCl3
На поверхности стального изделия происходит выделение атомарного алюминия AlCl3 +Fe → FeCl3 + Al, который диффундирует в сталь.
Значительное повышение жаростойкости стали термодиффузионным покрытием обусловлено образованием окислов Al2O3 или двойных окислов FeAl2O4 в алитированном слое. На поверхности хромированных или силицированных изделий образуются соответствующие оксиды хрома или кремния.
В нефтезаводской аппаратуре широко применяют алитирование труб для крекинг-печей, в результате чего долговечность труб увеличивается в 3-4 раза.
Термомеханический метод (плакирование) применяют для изготовления биметаллических листов. На заготовку с одной или обеих сторон накладывают тонкие листы защитного металла, и полученный пакет подвергают совместной прокатке. Толщина защитного листа составляет 4-10% от толщины основного металла. Биметаллические листы ВстЗ (или16ГС)-ОХ13 или ОХ18Н9Т применяют для корпусов ректификационных колонн и реакторов. Применение жаростойких биметаллов дает возможность экономить около 60-70% высоколегированной стали и большое количество легирующих элементов.
Напыление (металлизация) состоит в нанесении расплавленного жаростойкого металла на поверхность защищаемой конструкции в собранном виде. На нефтеперерабатывающих заводах применяют металлизацию алюминием для защиты внешней поверхности колонн, резервуаров, труб и др. В некоторых случаях металлизация алюминием применяется с последующим отжигом для получения термодиффузионного покрытия.
Водородная коррозия стали
Высокотемпературная водородная коррозия стали проявляется во многих технологических процессах нефте- и газопереработки, связанных с применением водорода при высоких температурах и давлениях, таких как производство аммиака, метанола, гидрогенизация нефти и др.
В этих условиях воздействие водорода вызывает водородную коррозию стали, которая приводит к обезуглероживанию, газонасыщению и охрупчиванию стали. Механизм водородной коррозии включает следующие стадии: при высоких температурах молекулярный водород диссоциирует на атомы, которые сорбируются поверхностью стали и диффундируют в ее кристаллическую решетку. Будучи активным восстановителем, атомарный водород восстанавливает карбид железа и взаимодействует с растворенным в стали углеродом по необратимо протекающим реакциям:
Fe3C + 2H2 ® 3Fe + CH4 и C + 4H ® CH4,
лишая таким образом сталь ее упрочняющей основы.
Так как диффузионные процессы, в том числе и перемещение водорода, легче всего реализуются по границам зерен, где преимущественно и располагаются пластинки цементита, то их разрушение водородом приводит к нарушению связи между кристаллитами и соответственно к снижению пластичности стали. Образующийся метан из-за значительно больших размеров молекул по сравнению с параметрами кристаллической решетки феррита не может диффундировать из объема металла и скапливается в его микрополостях и дефектах, вызывая высокое внутриполостное давление и приводя к растрескиванию стали. При этом трещины развиваются по границам зерен. В мягких сталях с низкими прочностными свойствами скопления метана происходят преимущественно в приповерхностном слое, образуя вздутия, отчетливо выделяющиеся на поверхности стали.
Помимо участия в образовании метана водород обладает хорошей растворимостью в металле. Концентрация растворенного в металле водорода зависит от парциального давления водорода на границе металл - газ и может определяться по формуле:
 ,
,
где r - количество растворенного водорода в стали, см3/100г;
p - парциальное давление водорода, ат;
Ks – растворимость водорода в стали при p=1ат.
Так как растворение водорода металлом является процессом эндотермическим, то растворимость водорода увеличивается с повышением температуры. Водородопроницаемость (V) может быть выражена уравнением
 ,
,
где V0 – постоянная, численно равная V при 1/T = 0.
Водородопроницаемость стали зависит от содержания в ней углерода и легирующих элементов и уменьшается с увеличением содержания углерода, о чем свидетельствуют данные, приведенные в табл. 4.
Таблица 4
Влияние содержания углерода на водородопроницаемость
углеродистых сталей
| Металл | С, вес.% | V, см3/см2ч мм–1 |
| Техническое железо Сталь 15 Сталь 30 Сталь У10А | 0,04 0,15 0,27 1,10 | 5,10 4,09 2,79 2,24 |
Водородная коррозия проявляется не сразу с момента воздействия водорода на сталь, а через определенный промежуток времени. Это время, в течение которого не происходит изменений микроструктуры и механических свойств стали, называется инкубационным периодом процесса обезуглероживания стали.
Инкубационный период имеет важное практическое значение, так как он по существу определяет безопасное время эксплуатации оборудования. Инкубационный период зависит, в основном, от температуры и давления. С повышением температуры и давления время инкубационного периода уменьшается. Вместе с тем на продолжительность инкубационного периода большое влияние оказывает химический состав стали. Так, например, инкубационный период для стали 30ХМА (рис.11б) значительно превышает таковой для стали 20 (рис. 11а).
Температура и парциальное давление водорода влияют не только на продолжительность инкубационного периода, но и на скорость обезуглероживания стали при водородной коррозии. Это влияние можно определить по уравнению:
lg K = -Q / (2,3RT) + kp + A,
где K – константа скорости обезуглероживания,
Q – энергия активации процесса обезуглероживания, кДж;
R – универсальная газовая постоянная, кДж/(моль.К );
T – абсолютная температура, К;
p – парциальное давление водорода, кПа;
k, A – коэффициенты.

Методы защиты от водородной коррозии
Одним из основных путей повышения водородоустойчивости сталей является их легирование сильными карбидообразующими элементами, образующими более стабильные карбиды, чем цементит. Такими элементами являются хром, вольфрам, молибден, ванадий, ниобий, титан.
Большое влияние на водородоустойчивость стали имеет тип карбидной фазы. В сталях, легированных хромом, водородоустойчивость понижается в зависимости от состава карбидной фазы в следующем порядке:
(Cr,Fe)23C6 ® [ (Cr,Fe)23C6 + (Cr,Fe)7C3] ® (Cr,Fe)7C3 ®
[(Cr,Fe)7C3 + (Fe,Cr)3C] ® (Fe,Cr)3C
Приведенный ряд показывает, что наибольшая водородоустойчивость в хромистых сталях достигается при образовании карбидов типа (Cr,Fe)23C6. Образование этого типа карбида при содержании углерода в стали 0,05% происходит при наличиии в стали хрома не менее 6%, а при увеличении содержания углерода необходимо повышение содержания хрома.
При легировании стали более сильными карбидообразующими элементами, чем хром, наибольшая водородоустойчивость стали достигается при содержании этих элементов в количестве, достаточном для связывания всего углерода в карбиды типа MeC.
В случаях, когда элементы оборудования работают и в условиях высокого уровня механических нагрузок, водородоустойчивые стали должны обладать и жаропрочностью. Для этих условий применяют стали с 3% хрома, дополнительно легированные молибденом, ванадием или вольфрамом, например сталь марки 20Х3МВФ (ЭИ579). Еще большей стойкостью обладают стали марок Х5М, Х5ВФ,Х9М, 1Х13. В наиболее тяжелых условиях применяют аустенитные жаропрочные хромоникелевые стали 0Х18Н10Т или Х17Н17М2Т.
Другим широко применяемым способом повышения водородоустойчивости сталей является плакирование их металлами, имеющими более низкую водородопроницаемость, чем основной металл. Это позволяет снизить концентрацию водорода на границе раздела основного металла и плакирующего слоя и снизить его агрессивное воздействие на основной металл.
Расчет эффективного давления водорода на границе раздела металлов основа-покрытие производится по уравнению:

где p1 – давление водорода на внешней поверхности плакирующего слоя;
p2 – эффективное давление водорода на границе покрытие-основной металл;
a = V1/V2 - отношение водородопроницаемости плакирующего слоя и основного металла;
b = l1/l2 – отношение толщины плакирующего слоя и основного металла.
По возрастанию водородопроницаемости металлы и сплавы можно расположить в ряд: алюминий, медь, никель, Х18Н10Т, 0Х13. В практике химической и нефтеперерабатывающей промышленности применяются преимущественно биметаллы из углеродистых или низколегированных сталей с защитным слоем из сталей 0Х13 или Х18Н10Т.
Рабочую температуру оборудования из выбранной стали следует поддерживать на 25оС ниже той, при которой возможна ее водородная коррозия.
Коррозия сернистыми соединениями при высоких температурах
Удельный вес сернистых нефтей и природных газов в общем объеме добываемого углеводородного сырья непрерывно возрастает. Содержание серы в нефти может быть различным и изменяться в широких пределах. По содержанию общей серы нефти принято делить на три группы: малосернистые (до 0,5%), сернистые (0,51 – 1,90%) и высокосернистые (более 1,90%). В нефтях, богатых серой, содержится сероводород и может содержаться элементарная сера. В нефтях могут находиться также меркаптаны – тиоэфиры, в которых атом кислорода замещен серой (RSH), сульфиды (RSR), дисульфиды (RSSR), тиофены – соединения, содержащие, наряду с серой, кислород.
В процессе переработки нефти сернистые соединения подвергаются многообразным превращениям, в результате которых из менее активных соединений выделяются сероводород, меркаптаны и элементарная сера, обладающие наибольшим коррозионным воздействием на металл. Поэтому общее содержание серы еще не указывает на степень ее коррозионной агрессивности, которая зависит также от термической устойчивости сернистых соединений. Наибольшей склонностью к распаду обладают меркаптаны, затем сульфиды и дисульфиды. Наиболее устойчивыми являются тиофены. Они разлагаются лишь при температурах выше 850оС, поэтому не оказывают значительного влияния на коррозию оборудования в типовых поцессах переработки нефти. Содержание сернистых соединений во фракциях сернистой нефти возрастает с повышением температуры кипения фракций.
Большинство сернистых нефтей и природных газов, содержащих сероводород, способны на определенных ступенях технологического цикла их переработки вызывать коррозию технологического оборудования. Коррозия сернистыми соединениями при высоких температурах протекает по механизму химической коррозии, а при низких температурах в присутствии влаги – по электрохимическому механизму.
Высокотемпературная сероводородная коррозия
Наиболее агрессивным коррозионным агентом при переработке нефти и газа является сероводород, как растворенный в сырой нефти или газе, так и выделяющийся при разложении других сернистых соединений. Сероводород действует на сталь при высоких температурах, вызывая химическую коррозию аппаратуры (змеевики печей, нижняя часть атмосферной колонны и др.), согласно реакции:
Fe + H2S ® FeS + H2.
Помимо этого процесса быстрого окисления стали сероводородом может происходить взаимодействие его с карбидом железа, входящим в структуру конструкционных сталей, по схеме:
Fe3C + H2S ® FeS + CH4 + Н2.
Под влиянием высоких температур происходит термическая диссоциация сероводорода, в результате которой образуется активная элементарная сера:
H2S ® H2 + S.
С повышением температуры увеличивается степень диссоциации сероводорода и давление паров серы, что приводит к резкому увеличению скорости коррозии металла.
При температуре ниже 260ºС скорость коррозии настолько низка, что она практически не фиксируется. Не наблюдается высокотемпературной сероводородной коррозии и при парциальном давлении сероводорода ниже 6Па. Предельные условия, при которых существует термодинамическая возможность высокотемпературной сероводородной коррозии, отвечают уравнению:
lg p = 1,34×10–3t – 2,6,
где p - парциальное давление сероводорода в рабочей среде, кПа;
t – температура среды, ºС.
В температурном интервале 260-455ºС скорость высокотемпературной сероводородной коррозии всех используемых в нефтегазопереработке конструкционных материалов повышается с повышением температуры, причем состав стали оказывает очень сильное влияние. Как видно из рис. 12, при различных температурах и содержании в среде 0,6% сероводорода скорость коррозии углеродистой стали на два порядка превышает скорость коррозии хромоникелевой стали аустенитного класса.
С повышением температуры коррозионной среды выше 455ºС скорость коррозии уменьшается. Это связано как с закоксовыванием поверхности металла, учитывая, что коксовые отложения обладают некоторыми защитными свойствами, так и с возрастанием возможности разложения сероводорода при высоких температурах.
В смесях сероводорода с водородом, имеющих большое распространение в процессах переработки нефти, вблизи равновесных значений концентраций H2S и H2 имеет место экстремальный характер температурной зависимости сероводородной коррозии (рис. 13).
С увеличением содержания Н2S в смеси экстремум смещается в сторону более высоких температур. Так как реакция H2S + Fe ® H2 + FeS + Q экзотермична, то дальнейшее повышение температуры в соответствии с принципом Ле Шателье способствует ее протеканию в обратном направлении, что приводит к снижению скорости коррозии. При далеких от равновесного соотношениях H2S и H2 в технологических средах, то есть при высоких содержаниях H2S, температурная зависимость скорости сероводородной коррозии имеет монотонный характер.


|
Высокотемпературная коррозия в присутствии меркаптанов
Меркаптаны нерастворимы в воде, но хорошо растворяются в органических растворителях. Они обладают свойством замещать атом водорода атомом металла, образуя меркаптиды по уравнению:
2RSH + 2Me ® 2RSMe + H2.
Меркаптаны, обладающие низким молекулярным весом, более коррозионно активны, чем высокомолекулярные меркаптаны.
При температурах 300 – 475оС меркаптаны разлагаются с образованием сероводорода
CnH2n-1SH ® H2S + CnH2n-2.
Присутствие элементарной серы усиливает действие меркаптанов, способствуя выделению сероводорода по реакции:
2RSH + S ® H2S + RSSR.
Наличие в газовой смеси водорода также способствует выделению сероводорода
RSH + H2 ® RH + H2S.
В этих случаях коррозия протекает по реакциям высокотемпературной сероводородной коррозии.
Высокотемпературная коррозия в присутствии сульфидов
и дисульфидов
Сульфиды содержат значительную часть общей серы в сернистой нефти, в то время как дисульфиды присуствуют в незначительном количестве. Сульфиды и дисульфиды при температурах до 130 – 160оС распадаются с выделением меркаптанов или сероводорода по схемам:
CnH2n-1

 S ® CnH2n-1SH + CnH 2n-2
S ® CnH2n-1SH + CnH 2n-2
CnH2n-1
 CnH2n-1
CnH2n-1
 S ® H2S + 2CnH2n-2,
S ® H2S + 2CnH2n-2,
CnH2n-1
а с повышением температуры коррозия протекает по реакциям высокотемпературной коррозии в присутствии меркаптанов и сероводорода.
Методы защиты от высокотемпературной коррозии
сернистыми соединениями
Для повышения коррозионной стойкости и защиты от коррозии сернистыми соединениями технологического оборудования при высоких температурах применяются следующие меры: использование легированных сталей, применение покрытий, очистка сырья от сероводорода.
Главным легирующим элементом, повышающим стойкость стали против высокотемпературной сероводородной коррозии, является хром. На стали, легированной хромом, образуется прочно сцепленная с основным металлом пленка, состоящая из смешанных сульфидов железа и хрома шпинельного типа и обладающая высокими защитными свойствами.
Введение никеля резко снижает стойкость стали к сероводородной коррозии, однако наличие хрома устраняет его вредное влияние. Оптимальным для коррозионной стойкости является соотношение Cr:Ni>1:2. Стали типа 18-8, 18-20 и сплавы типа инколой 20-32 и 20-40 превосходят по стойкости сплавы типа инконеля 20% Cr-65% Ni или нимоника 20% Cr-80% Ni.
Алюминий обладает высокой стойкостью против сероводорода и применяется в виде покрытий, наносимых на сталь термодиффузионным способом, металлизацией или горячим погружением.
С целью экономии легированных сталей применяется также биметаллический прокат с основным слоем из углеродистой или низколегированной стали и плакирующего слоя из хромистой или хромоникелевой стали.
Очистка нефтепродуктов от серы производится гидрогенизационным методом с последующей доочисткой поглотителями (например, моноэтаноламином и др.). Гидроочистка сырья от серы практически исключает существенную высокотемпературную коррозию при каталитическом риформинге.
Коррозия в неэлектролитах
Большинство органических соединений практически не обладает электропроводностью. Следовательно, в них принципиально невозможна работа микроэлементов, поскольку электропроводность среды является одним из основных условий протекания электрохимического коррозионного процесса. Из жидких неэлектролитов опасность в коррозионном отношении представляют главным образом органические вещества, обладающие достаточной активностью: сернистая нефть и продукты ее переработки, безводные спирты, бензол, хлороформ и др.
В чистых углеводородах нефти и продуктах ее переработки металлы не корродируют. Даже такие легко окисляющиеся металлы, как калий и натрий, хорошо сохраняются в керосине и бензоле.
Нефть состоит в основном (до 90 %) из углеводородов. Коррозионную активность нефти придает наличие в ней различных ингредиентов: минеральные соли, нафтеновые кислоты, серо-, азот-, кислород- и хлоросодержащие органические соединения, смолистые вещества, соединения ванадия и др. При переработке нефти под воздействием высоких температур, давлений, различных технологических сред происходит расщепление и превращение ингредиентов сырой нефти с образованием продуктов, оказывающих активное коррозионное воздействие на металл аппаратуры.
Таким образом, нефть, малоагрессивная при обычных температурах, приобретает в процессе переработки коррозионную активность и вызывает усиленную химическую коррозию при высоких температурах. При низких температурах коррозия в нефти и в нефтепродуктах обычно имеет электрохимический характер.
Коррозия под действием серы
На нефте- и газоперерабатывающих комбинатах сера получается из газов, содержащих значительное количество сероводорода. Сера переходит из кристаллического состояния в жидкое при температуре 119оС, температура кипения ее составляет 444,6оС.
Расплавленная сера, взаимодействуя с поверхностью стали, образует на ней слой продуктов коррозии, который может иметь неоднородное строение.
Зона, прилегающая к внешней поверхности, состоит из немагнитного пирита – FeS2, промежуточная зона состоит из троилита переменного состава от FeS до FeS1,5 , а зона на границе с основным металлом – пирротит. Лимитирует скорость химической коррозии диффузия ионов железа через слой продуктов коррозии.
В жидкой сере по пятибальной шкале коррозионной стойкости углеродистая сталь и чугун являются стойкими при температурах до 200оС. При наличии влаги и аэрации скорость коррозии черных металлов значительно возрастает. Так, при температуре 125оС аэрация повышает скорость коррозии углеродистой стали в расплавленной сере с 0,03 до 0,45 мм/год.
С повышением температуры скорость коррозии сталей и чугунов увеличивается: при температуре 260оС – до 0,25мм/год, а при 440оС – до 4,0 мм/год. В парах серы скорость коррозии еще выше: при температуре 260оС – 0,5 мм/год, а при 410оС повышается до 12 мм/год.
Температурные режимы работы оборудования на разных этапах получения серы и ее хранения существенно различаются. Так, в конверторе температура на входе 280оС, а на выходе 373оС, в реакторе-генераторе 300оС, а в экономайзере 252оС. В яме хранения жидкой серы условия различаются для жидкой и паровой фаз: в жидкой фазе (низ ямы) температура 130оС, а среда представляет собой расплавленную серу, сероводород и пары воды; в паровой фазе (верх ямы) температура 100оС, а среда – пары серы, сероводород, сернистый газ, кислород и пары воды.
С наибольшей скорость корродирует углеродистая сталь как в жидкой, так и в паровой фазах, содержащих одновременно H2S, SO2 и CO2. На нефтеперерабатывающих заводах, где в парообразной фазе над расплавленнной серой отсутствует CO2, скорость коррозии может снизиться до 0,02 мм/год.
В жидкой сере коррозионностойки хромистые стали с содержанием хрома более 13%, а также хромоникелевые и хромомарганцовистые. При температурах выше 300оС коррозионностойки лишь хромистые стали, содержащие 17 и более процентов хрома, а также стали 12Х18Н10Т и 06Х17Н15МАБ. В связи с тем, что сера может способствовать развитию межкристаллитной коррозии, легированные стали, используемые для изготовления тонкостенных элементов, должны обладать стойкостью к этому виду коррозионного разрушения.
Алюминий и его сплавы коррозионностойки в жидкой и парообразной сере до температуры 500оС и могут использоваться в качестве защитных покрытий.
Никель и его сплавы нестойки к воздействию серы в любом виде при температурах выше 315оС, так как они становятся хрупкими. Поэтому никелевые сплавы не следует применять в качестве конструкционных материалов ни в окислительных, ни в восстановительных средах, содержащих серу, при высоких температурах.
Титан и его сплавы подвергаются интенсивной коррозии в сере, начиная с температуры 400оС, а при температуре 500оС полностью разрушаются.
Карбонильная коррозия
Карбонильная коррозия – это химическая коррозия металлов под воздействием оксида углерода при высоких температурах и давлениях, приводящая к образованию легко летучих жидкостей – карбонилов:
Me + n(CO) ® Me(CO)n
С использованием оксида углерода связаны технологические процессы производства метанола, сложных эфиров, высших органических кислот и др., стальное оборудование которых может подвергаться карбонильной коррозии с образованием пентакарбонила железа. Пентакарбонил железа Fe(CO)5 представляет собой кипящую при 102ºC жидкость, пары которой при давлении 1 ат и температуре выше 140ºС практически полностью диссоциируют на Fe и CO. Скорость образования карбонилов зависит от температуры и давления, для образования пентакарбонила железа такая зависимость показана на рис. 14.
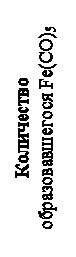

Из рисунка видно, что максимальное количество пентакарбонила образуется при температуре около 200оС. При более высоких температурах вследствие высокого давления паров разложившегося карбонила воздействие СО на железо уменьшается. При температурах ниже 90оС и выше 300оС оксид углерода практически не взаимодействует с металлами. При повышении давления скорость карбонильной коррозии возрастает, однако температурная зависимость скорости коррозии сохраняется. При атмосферном
|
Карбонильная коррозия вызывает местную коррозию с образованием глубоких язв на поверхности углеродистых и низколегированных сталей. Повышенной коррозионной стойкостью к карбонильной коррозии обладают стали, легированные хромом. Наиболее стойки в среде оксида углерода стали, содержащие 18% и более хрома (Х18Н10Т, Х21Н15Т, Х25Т). Высокой стойкостью в среде оксида углерода обладают медь и ее сплавы и алюминий и его сплавы.
Коррозия нафтеновыми кислотами
Нафтеновые кислоты – это органические соединения, которые могут присутствовать в природных углеводородах и в определенных условиях взаимодействия с металлами приводить к их химической коррозии. Они плохо растворяются в воде, но хорошо – в органичнеских растворителях, в том числе в углеводородах. Содержание нафтеновых кислот в нефтях различных местрождений может быть от сотых долей процента, как, например, в нефтях Урало-Волжской нефтеносной провинции, или доходить до 2 – 3%, а на месторождениях, наиболее богатых нафтеновыми кислотами, например, в нефтях Ильского месторождения, до 6%.
В дистиллятах одной и той же нефти нафтеновые кислоты распределены неравномерно; обогащаются ими преимущественно соляровые и веретенные дистилляты, а керосиновые – мало.
Коррозия нафтеновыми кислотами, как правило, интенсивно протекает в горячих нефтяных потоках и только при наличии в среде воды или мокрого пара и особенно интенсивно в зоне конденсации. В среде сухого пара она отсутствует.
Растворимость продуктов коррозии в горячих нефтях делает характер этого коррозионного разрушения похожим на эрозионный износ – поверхность образующихся раковин, а при высоких скоростях потока – желобков с острыми краями, остается чистой и блестящей.
Коррозионная агрессивность нефти и нефтяных прогонов, содержащих нафтеновые кислоты, характеризуется кислотным числом, которое оценивается количеcтвом KOH на нейтрализацию 100 г пробы. Коррозия проявляется, если коррозионное число составляет не менее 50 мг KOH на 100 г продукта. С удвоением кислотного числа при прочих равных условиях скорость коррозии углеродистой и низколегированной стали может увеличиваться до 5 раз. Наиболее серьезные разрушения появляются при кислотном числе 100 мг KOH на 100 г продукта. Кислотное число нафтеновых кислот обратно пропорционально их молекулярной массе, наиболее активны кислоты с молекулярной массой до 300.
Помимо концентрации и молекулярной массы этих кислот на скорость коррозии большое влияние оказывают температура и скорость потока.
При нормальной температуре скорость коррозии незначительна, а усиленная коррозия наблюдается в интервале температур от 220 до 440оС, достигая максимума при 280 – 300оС. В этом интервале температуры и при высоком содержании в среде нафтеновых кислот скорость коррозии углеродистой стали может достигать 10 мм/год. При температурах выше 300оС интенсивность коррозионного разрушения стали снижается, что объясняется термическим распадом нафтеновых кислот, продукты распада которых обладают меньшей коррозионной агрессивность по сравнению с самими кислотами.
Скорость коррозии значительно возрастает с увеличением скорости потока, так как образующиеся под воздействием нафтеновой кислоты продукты коррозии легко размываются и уносятся движущимся потоком. Максимальные скорости коррозии наблюдаются в тех местах, где существует турбулентный поток.
В процессах первичной переработки нефти на установках АВТ(АТ) коррозия нафтеновыми кислотами имеет место в основном на блоках атмосферной и вакуумной перегонки нефти, где температуры процессов поддерживаются в диапазоне 200 – 400оС. Разрушениям подвергаются трубы и печные двойники на выходе из радиантных секций печей, трубопроводы от печей до ректификационных колонн, корпуса колонн в зоне ввода горячей струи нефти, ректификационные тарелки эвакопорационного пространства под питательным вводом.
Склонность сталей к коррозии под действием нафтеновых кислот определяется главным образом их химическим составом. Легирование сталей хромом до 13% не обеспечивает их стойкости к коррозии нафтеновыми кислотами. Хромоникелевые и хромоникельмолибденовые аустенитные стали типа 12Х18Н10Т и 10Х17Н13М3Т проявляют высокую стойкость против рассматриваемого вида коррозионного разрушения.
Устойчивыми к коррозии под действием нафтеновых кислот являются алюминиевые сплавы, не содержащие меди. Однако их использование ограничено из-за низких прочностных свойств при повышенных температурах и свариваемости.
Медь и ее сплавы как конструкционные материалы для этих условий не применяются, так как они подвергаются интенсивному разрушению при температурах более 150оС и являются катализаторами разложения высокомолекулярных нафтеновых кислот. По этой же причине не применяются и стали, легированные медью.
Для предупреждения коррозии оборудования под действием нафтеновых кислот используют и технологические способы: компаундирование нефти с высоким содержанием низкомолекулярных нафтеновых кислот и нефти с низким их содержанием, а также предварительное удаление нафтеновых кислот в эвапораторах. Нейтрализация технологических сред практически не применима, так как это приводит к загрязнению и снижению качества продуктов перегонки.
 2018-01-08
2018-01-08 2640
2640