Пример. При электролизе 40 моль воды получилось 620 г кислорода. Определить процент выхода кислорода от теоретически возможного выхода.
Решение:
1)Сколько кислорода выделяется при электролизе 40 моль воды при 100% - ном выходе?
40 моль Х%
2H2O = 2H2 + O2
2 моль 32 г
2 моль - 32 г
40 моль - Х г
2: 40 = 32: Х
Х = 640 (г).
2) Чему равен процент выхода кислорода?
640 г составляют 100% - ный выход
620 г составляют Х% - ный выход
Х = 96,88.
Ответ: 96,88%
Справочный материал:
Массовая доля выхода продукта реакции (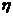 )- это отношение массы продукта реакции, полученного практически, к массе продукта, рассчитанного теоретически:
)- это отношение массы продукта реакции, полученного практически, к массе продукта, рассчитанного теоретически: 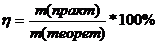
Задания:
1)Сколько перекиси водорода образуется при действии 49 г H2SO4 на 84,5 г перекиси бария при 98%-ном выходе? (Ответ: 16,66 г.)
2)При окислении 19,2 кг SO2 кислородом воздуха получено 22,51 кг SO3. Какой процент о теоретически возможного выхода составляет это количество? (Ответ: 93,79%.)
3)При обжиге 0,5 т пирита, содержащего 45% серы, получается 440 кг SO2. Вычислить выход SO2 в процентах от теоретически возможного. (Ответ: 97,78%.)
 2018-01-08
2018-01-08 1370
1370
