Решение многих задач по химии значительно упрощается, если при вычислениях применяются газовые законы и вытекающие из них фактические выводы:
1 моль любого газа (или пара) занимает при нормальных условиях, т. е. при 00С и 760 мм давления, объём, равный 22,4 литра;
молекулярная масса (М) газа (или пара) равна его удвоенной плотности по водороду (D):
М = 2D
D =  .
.
Так как водород легче воздуха в 14,5 раза, то плотность газа по воздуху (d) равна:
d = 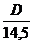 .
.
D = 14,5d.
Поставив в формулу М + 2D значение D, равное 14,5 d, получаем:
М = 2 × 14,5d или М = 29d.
d = 
Так как 1 моль газа занимает при нормальных условиях объём, равный 22,4 л, то, зная формулу газа, можно вычислить:
а)объём, занимаемый 1 граммом газа при нормальных условиях, по формуле:
V = 
б) массу 1 литра газа, измеренного при нормальных условиях:
m =  .
.
Если же известна масса 1 литра газа, измеренного при нормальных условиях, то легко вычислить молекулярную массу газа (моль) по формуле:
1 моль = 22,4 × m
 2018-01-08
2018-01-08 242
242








