Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG0), а затем использованию формулы:
 ,
,
где 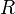 — универсальная газовая постоянная.
— универсальная газовая постоянная.
При этом следует помнить, что энергия Гиббса — это функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию. В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Расчетное задание
Химическая Реакция:2H2О=2H2+О2
Исходное вещество: 2H2О ;продукты реакции: 2H2 и О2.
Справочные данные:
| Вещество | Фазовое состояние | а |  | 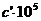 |  Дж/моль Дж/моль |  Дж/(моль*К) Дж/(моль*К) |
| H2O | Газ | 30,00 | 10,71 | 0,33 | -241840 | 188,74 |
| H2 | Газ | 27,28 | 3,26 | 0,502 | 130,6 | |
| О2 | Газ | 31,46 | 3,39 | -3,77 | 205,03 |
Расчет 
 ,
, 

ΔH°298 = ΔH°298 (2H2) + ΔH°298 (O2) – ΔH°298 (2H2O) = 2*0+2*0-2*(-241840)= 483680Дж/моль
ΔS°298 = ΔS°298 (2H2) + ΔS°298 (О2) – ΔS°298 (2H2O)= 2*130,6+205,03-2*188,74= 88,75Дж/моль*К
ΔG°298=ΔH°298 - TΔS°298 = 483680 – 298 · 88,75 = 457233Дж/моль
Расчет 


 :
:
Δa= 31,46+2*27,28-2*30,00= 26,02;
Δb = (3,39+2*3,26-2*10,71)*10-3 = -11,51*10-3;
Δc = (-3,77+2*0,502-2*0,33)*105 = -3,426*105;
Δ  ° = ΣCpпрод – ΣCpисх= Δa + ΔbT + ΔcT-2 =26,02 – 11,51*10-3 *298-3,426*105/2982=18,732 Дж/моль*К
° = ΣCpпрод – ΣCpисх= Δa + ΔbT + ΔcT-2 =26,02 – 11,51*10-3 *298-3,426*105/2982=18,732 Дж/моль*К
Расчет 
 :
:
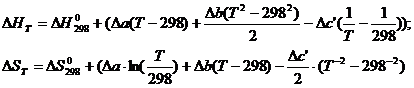
РасчетΔ  ;
; 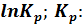
 ;
;
 ;
;
 .
.
Результаты расчета
| Термодинамические параметры | Размерность | Т, К | |||||||
| 298 | |||||||||
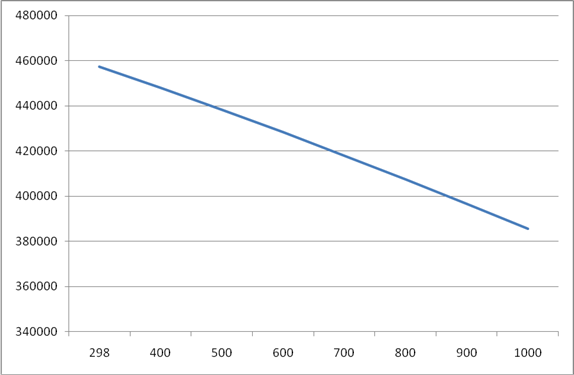
| ΔHT | Дж/моль | ||||||||
| ΔST | Дж/моль*К | 88,75 | 94,37 | 98,66 | 102,03 | 104,76 | 107,02 | 108,85 | 110,42 |
| ΔCP | Дж/моль*К | 18,732 | 19,275 | 18,895 | 18,162 | 17,264 | 16,277 | 15,238 | 14,167 |
| ΔGT | Дж/моль*К | ||||||||
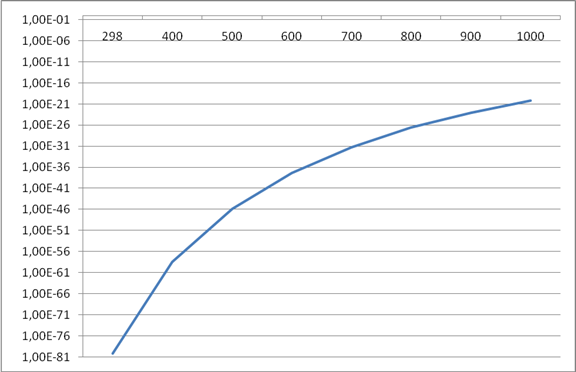
| ln KP | - | -184,638 | -134,738 | -105,463 | -85,876 | -71,832 | -61,257 | -53,012 | -46,385 |
| KP | - | 6,50*10-81 | 3,05*10-59 | 1,58*10-46 | 5,06*10-38 | 6,36*10-32 | 2,49*10-27 | 9,49*10-24 | 7,17*10-21 |
Графики зависимостей
ΔH(Т)

ΔS(Т)

CP(Т)

ΔG(Т)
KP (Т)
Расчет параметра β:
1. Найти степень превращения  реакции при стандартном давлении, при заданном давлении, а также вычислить при каком давлении степень превращения
реакции при стандартном давлении, при заданном давлении, а также вычислить при каком давлении степень превращения  вещества станет равной заданному значению. Температура процесса равна 800 К.
вещества станет равной заданному значению. Температура процесса равна 800 К.


2H2 + O2 = 2H2O

Расчет состава равновесной смеси при Р = 1 атм и Т = 800 К.


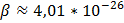
Расчет состава равновесной смеси при Р = 5атм и Т = 800 К.



Расчет состава равновесной смеси при  = 0,1 и Т = 800 К.
= 0,1 и Т = 800 К.



Список литературы
1. Михайлова М. С., Малкова А. С. Физическая химия: Методические указания по выполнению семестровых заданий и курсовых работ. В 2-х частях. Часть 1. – М.: МИЭТ, 2009.
2. Глазов В.М. Основы физической химии М.: Высшая школа, 1981
3. Киреев В.А. Краткий курс физической химии. - М.: Химия, 1978
4. Герасимов Я. И. Курс физической химии. – М.: издательство «Химия», 1970.
 2018-01-08
2018-01-08 2470
2470
