Доп инфа-мв квадрат деленое на два равно полтора катэ.
25.Средняя энергия молекул. Классическая теория теплоемкости идеальных газов. Ее недостатки.
(<Eпост>=<mu^2/2> -среднее значение поступ кинет энергии молекул)
<Eпост>=3/2*kT, p=nkT (n-конентрация, k-постоян Больцмана)
<Eпост>=i/2*kT(где i сумма степеней свободы, причем i=iпост+iвр+2iкол)
Доп инфа-мв квадрат деленое на два равно полтора катэ.
Сp-Cv=R, γ=Cp/Cv, γ-1=R/Cv, Cv=R/ γ-1, Cp= γR/ γ-1 комнат. t
1)Одноатомный газ i=3; U=CvT=3/2*RT, Cp=5/2*R, Cv=3/2*R, γ=5/3 (He -1,66)
2)двухатомные жестк. Молекулы i=5, U=CvT=5/2*RT, Cv=5/2*R, Cp=7/2*R, γ=7/2=1/4(H2-1/4, N2,O2)
3)Слажные: i=6, Cv=3R, Cp=4R, γ=4/3=1.33(CH4, SO2)
u≈u(среднее), u~  Недостатки клас теории теплоемкости-
Недостатки клас теории теплоемкости-
1)она не учитывает некоторые степени свободы 2)не укладывается зависимость С от T
3) Даже при "Комнатных" температурах теплоюмкости разных газов с одиннаковыми количеством атомов отличаються дркг от друга, и не кратны R.
4) Согласно Кл. теории С газов не должно зависить от T, на самом деле С сильно понижаетися с понижением Т.




31.Экспериментальные изотермы. Фазовые превращения. Метастабильные состояния.
При высоких температурах (Т>Тк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К - Эта изотерма называется критической, соответствующая ей температу- температура Тк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление Pк называются также критическими. Состояние с критическими параметрами (Pк Vк, Tк)называется критическим состоянием. При низких температурах (Т<ТК) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь. Рассматривая различные участки изотермы при Т<Тк. Видим, что на участках 1—3 и 5—7 при увеличении объема Vm давление р падает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1.Часть 7—6 отвечает газообразному состоянию, а часть 2—1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества.
Эта кривая и критическая изотерма делят диаграмму р, Vm под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар),слева от нее находится область жидкого состояния,а справа — область пара.Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении. Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса, видим, что последняя имеет прямолинейный участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений. Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются.ПАР-газ который может быть ожижен.
+ - Q- фазовый переход 1-ого рода, ∆Q=0 фазовый переход2ого рода. Способность вещества иметь раличные крист формы – полиморфизм. Метастабильные состояния-1)фазовые 2)полиморфные-переход между разными кристал фазами
27.Вычисления с помощью функций распределения (Vвер.,Vсредняя.,Vср.кв.). Распределение Максвелла в приведенном виде.
Скорость определяется из условий dF/du=0, окуда следует u(вер)=  =
=  , средняя скорость по определению
, средняя скорость по определению  =
=  , среднеквадратичная скорость u(кв)=
, среднеквадратичная скорость u(кв)=  ; она находиться из условия
; она находиться из условия  откуда u(кв)=
откуда u(кв)=  Пропорция-u(вер):<u>:u(кв)=1:1.13:1.22||Решение ряда задач удобнее проводить, если выражать скорости u молекул в относит единицах-таких что они буду наиболее вероятны u(вер). Тогда относитеьная скорость молекулы U=u/u(вер). При переходе к новой переменой учтем, что должно выполняться равенство Ӻ(U)dU=F(u)du. Отсюда Ӻ(U)=F(u)*(du/dU) Заменив в правой части этого равенства u на U*u(вер) получим Ӻ(U)=(4/
Пропорция-u(вер):<u>:u(кв)=1:1.13:1.22||Решение ряда задач удобнее проводить, если выражать скорости u молекул в относит единицах-таких что они буду наиболее вероятны u(вер). Тогда относитеьная скорость молекулы U=u/u(вер). При переходе к новой переменой учтем, что должно выполняться равенство Ӻ(U)dU=F(u)du. Отсюда Ӻ(U)=F(u)*(du/dU) Заменив в правой части этого равенства u на U*u(вер) получим Ӻ(U)=(4/  )U^2 exp(-U^2). В таком виде распределение Максвелла является универсальным: оно не зависит не от температуры, ни от рода газа.
)U^2 exp(-U^2). В таком виде распределение Максвелла является универсальным: оно не зависит не от температуры, ни от рода газа.
30.Уравнение Ван-дер-Ваальса. Исследование уравнения Ван-дер-Ваальса.
В связи с тем, что с ростом давления(при T=const) оказывается, что p  ≠RT, то мы вынуждены внести поправки в формулу модели идеального газа, а именно (p+
≠RT, то мы вынуждены внести поправки в формулу модели идеального газа, а именно (p+  )(
)( )=RT-это и есть уравнение Вандервальса(а и b-постоянные, разные для разных газов)Если мы имеем дело с молями ν>1 то следует сделать замену:
)=RT-это и есть уравнение Вандервальса(а и b-постоянные, разные для разных газов)Если мы имеем дело с молями ν>1 то следует сделать замену:  =V/ν. Поправка a/
=V/ν. Поправка a/  ^2 обусловлена силами притяжения между молекулами(типо внутренее давление)Т.Е. при переходе из от идеального газа к реальному давление на стенку уменьшается(из-за сил притяжения между молекулами)Поправка b связана с собственным объемом молекул.
^2 обусловлена силами притяжения между молекулами(типо внутренее давление)Т.Е. при переходе из от идеального газа к реальному давление на стенку уменьшается(из-за сил притяжения между молекулами)Поправка b связана с собственным объемом молекул. 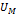 =CvT-a/
=CvT-a/  –внутренняя энергия Вандервальс газаю Раскроем скобки в уравнении Вандервальса, приведем к оббщему множителю,короче приведем к такому виду:p
–внутренняя энергия Вандервальс газаю Раскроем скобки в уравнении Вандервальса, приведем к оббщему множителю,короче приведем к такому виду:p  +aV-pb
+aV-pb  -RT
-RT  -ab=0 затем =p
-ab=0 затем =p  -(pb+RT)
-(pb+RT)  +aV=ab (тут 3 корня:1 действительный, 2 мнимых)
+aV=ab (тут 3 корня:1 действительный, 2 мнимых)
 При Tкрит-1 решение(пересечение прямой с кривой)
При Tкрит-1 решение(пересечение прямой с кривой)
При T0-3 решения(V1,V2,V3)Далее ищем крит точку из dp/dV=0. Вот эти данные можно подставить в уравнение Вандервалься и убедиться насколько отличны уравнения для идеал газа и урав вандера:  =3b;
=3b;  =a/27
=a/27  ;
;  =8a/27bR(крит параметры)
=8a/27bR(крит параметры)
Сравним стало: p  =3R
=3R  /8(в крит состоян);было p
/8(в крит состоян);было p  =RT
=RT
 2018-01-08
2018-01-08 407
407






