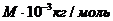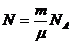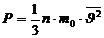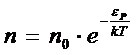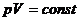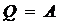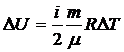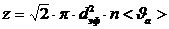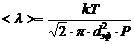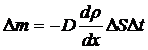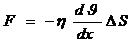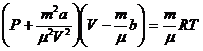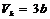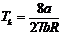Дененің массасы центрінен өтпейтін оске қатысты инерция моменті, центрінен өтетін және біріншіге параллель оске қатысты инерция моментімен массасының екі ось арақашықтығынын квадратының көбейтіндісінің қосындысына тең:
J=J0+ma2 (8)
Дәріс №8 Айналмасы қозғалыстың кинетиқалық энергиясы.
Әртүрлі денелердің инерция моменттерін өсептеу.
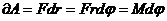 ,
, 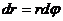 ,
, 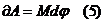 - элементарлы жұмыс.
- элементарлы жұмыс. 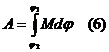 - толық жұмыс.
- толық жұмыс.
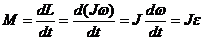
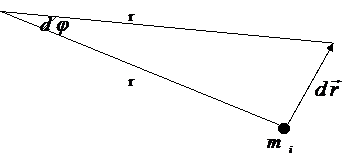
 - Ньютонның екінші заңы
- Ньютонның екінші заңы
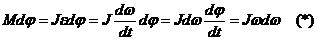
орындарына қоямыз
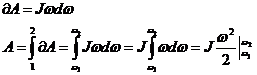
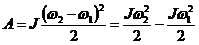 - кинетикалық энергияның өзгеру теоремасы
- кинетикалық энергияның өзгеру теоремасы
Ватты дененің инерция моментік өсептеу үшін оны ойымызша аз элементтерге болу қажет және олардың нүктелерінен айналыс осіне дейін бірдей арақашықтықта болу керек. Содан кейін әр элементтердің мысалары мен аралықтардың квадраттарына көбейтіндіні тауып және олардың қосындысын табуға болады.
Геометриялық пішіндері дұрыс денелер үшін инерция моментін интегралдық есептеулер арқылы табуға жол ашылған.
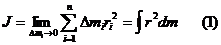
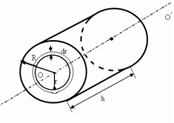 h - цилиндрдің биіктігі
h - цилиндрдің биіктігі
R- радиусы
Цилиндрді өте жұқа
концетрлік қабаттарға
қалындығы dr етіg
бөлеміз. Мейлі, кейбір
қабаттың радиусы r, оның
көлемін табамыз
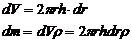
Қабатың барлық нүкрелері айналу осінен r аралықта болғандықтан, олардың инерция моменттері бірдей болады.
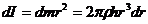
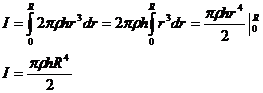 бірыңғай жазық цилиндр
бірыңғай жазық цилиндр
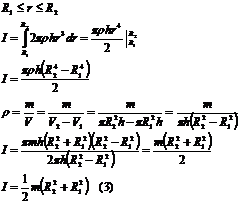 бос цилиндр R ішкі радиус және r сыртқы радиуспен
бос цилиндр R ішкі радиус және r сыртқы радиуспен
Инерция моменті кезкелген дененің айналымы.
(Жасаушы) жазық қисықтың айналу өстерi айналумен айнала құрастырылған денені қарап шығамыз.
Заттың тығыздығы мен F(h) байланысы белгілі болсын. Денені жіңішке дискке dh биіктікпен бөлеміз..Дисктің инерция моменті
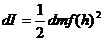
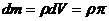
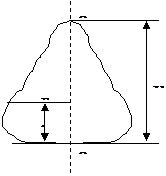
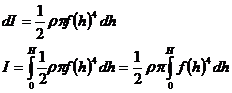 инерция моменті барлық дененің интегралды түрінде табылады.
инерция моменті барлық дененің интегралды түрінде табылады.
Дәріс №9 Молекула – кинетикалық теорияның негізгі қағидалары.
Молекулалық физиканың негізгі түсініктері
Молекула — заттардың физикалық қасиеттерін анықтайтын бөлшек. Молекулалар атомдардан тұрады. Қазір 109 химиялық атом белгілі. Оның ішінде 88-і табиғатта кездеседі, ал басқалары жасанды. Атом және молекулалардың сипаттамалары өте аз болғандықтан, абсолюттік емес салыстырмалы шамалармен сипаттайды. Молекуланың массасын алсақ, ол өте аз, сондықтан, оны грамм немесе килограмм шамасымен анықтау қолайсыз. 1961 жылдан бастап 1а.м.б. (атомның массалық бірлігі) кіргізілген:
1 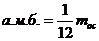 (1)
(1)
мұндағы 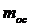 – көміртегі
– көміртегі 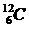 изотопының массасы,
изотопының массасы, 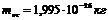 .
.
Молекуланың салыстырмалық  масса – ол зат молекуласы массасының көміртегі атомының
масса – ол зат молекуласы массасының көміртегі атомының 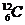 изотопы массасының 1/12 бөлігінің қатынасына тең шама:
изотопы массасының 1/12 бөлігінің қатынасына тең шама:
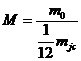 (2)
(2)
мұнда 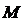 – молекуланың салыстырмалық массасы,
– молекуланың салыстырмалық массасы, 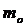 – молекуланың массасы.
– молекуланың массасы.
Зат мөлшері — ол заттың құрамындағы құрылыс элементтерінің саны арқылы анықталатын шама.
Затты, зат мөлшерімен анықтау үшін, белгілі бір санды, өлшем ретінде аламыз.
Зат мөлшерінің өлшем бірлігі – 1 моль.
1 моль — ол массасы 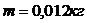
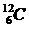 көміртегі изотопында қанша құрылыс элементтері болса, сонша құрылыс элементтеріне ие болатын зат мөлшері.
көміртегі изотопында қанша құрылыс элементтері болса, сонша құрылыс элементтеріне ие болатын зат мөлшері.
Онда зат мөлшері:
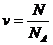 (3)
(3) 
Мұндағы 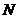 – зат молекулаларының саны,
– зат молекулаларының саны, 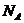 – Авогадро саны, ол 1 мольдегі молекулалар саны:
– Авогадро саны, ол 1 мольдегі молекулалар саны:
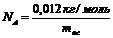 Авогадро саны (4)
Авогадро саны (4)
Есептей келе:
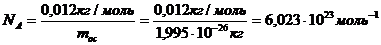 (5)
(5)
Мольдік масса – 1 моль зат мөлшерінің массасы:
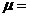
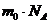 (6)
(6)
мұндағы 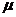 (мю) – мольдік масса.
(мю) – мольдік масса.
(1.2) және (1.4) формулаларын (1.5) қойып, мольдік массаны анықтайтын формуланы табамыз:
|
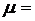
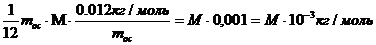 (7)
(7)
Мысалы, СО2, М=12+32=44
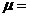
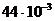 кг/моль
кг/моль
Зат мөлшері: 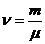 (8)
(8)
мұндағы  – газдың массасы,
– газдың массасы, 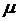 – мольдік массасы
– мольдік массасы
|
(9)
Идеал газдың моделі – ол келесі газдың моделі.
1) Өлшемдері ескерілмейтін қатты шариктер, яғни материалық нүкте ретінде қарастырылады.
2) Молекулалары тек соқтығысқанда ғана әсер етіледі. Әсерлесулері абсолютті серпімді соқтығысу заңдарымен анықталады.
3) Тек қана кинетикалық энергиялары ескеріледі
Қысым дегеніміз: 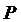
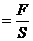 (10)
(10)
Молекуланың жылдамдық векторы: 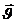 =
= 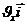 +
+ 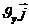 +
+ 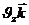
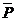 =
= 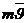 – молекуланың импульсі
– молекуланың импульсі
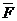 =
= 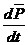 – динамиканың екінші заңының формуласы
– динамиканың екінші заңының формуласы
Газдың ыдыс қабырғасына түсіретін қысымы, оның молекулалары сол қабырғаға соқтығысуларының нәтижесі болып табылады. Мына суретте ыдыс қабырғасына бір молекула соқтығысқандағы оның импульсіның өзгерісін қарастырайық.
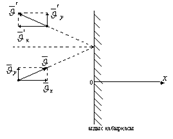
3.1-сурет
Сонымен, молекуланың соқтығысу кезінде жылдамдығының 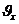 құраушысы ғана өзгереді. Ал,
құраушысы ғана өзгереді. Ал, 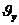 немесе (
немесе (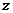 құраушысы өзгермейді)
құраушысы өзгермейді) 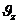 құраушылары өзгермейді. Онда бір молекуланың қабырғаға соқтығысқандағы импульс өзгерісі:
құраушылары өзгермейді. Онда бір молекуланың қабырғаға соқтығысқандағы импульс өзгерісі:
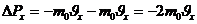
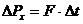
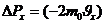

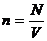 – молекулалар шоғыры
– молекулалар шоғыры
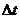 уақыт аралығында қабырғаға барлық соқтығысқан молекулалардың импульсінің өзгерісі.
уақыт аралығында қабырғаға барлық соқтығысқан молекулалардың импульсінің өзгерісі.
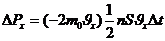
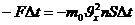 (11)
(11)
(11) формуласын 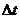 -ға қысқартамыз,
-ға қысқартамыз, 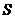 -қа бөлеміз. Онда:
-қа бөлеміз. Онда:
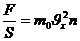
Бұдан қысым: 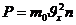
Молекуланың жылдамдығын ескерсек:
 =
= 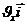 +
+ 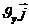 +
+ 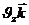 ,
,
модулі: 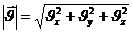
ал модулінің квадраты: 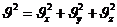
онда жылдамдық квадратының орташа мәні төмендегідей жазылады: 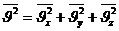
Молекулалар хаосты қозғалғандықтан, әр бағытта:
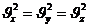
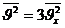
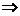
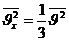
|
(3.3)
Физикалық мағынасы: бұл теңдеу газды толық сипаттайтын параметр қысым және молекулалардың сипаттамалары арасында салынған көпір. Біз заттың ішкі құрылысын көрмей, білмей отырып, бірақ осы теңдеу арқылы оның күйін молекулалардың сипаттамасы арқылы анықтаймыз.
Дәріс №10. Максвелл және Больцменнің үлестіруі.
 – газ молекуланың жылдамдықтары өзгеріп отырады. Бағыты бойынша, модулі бойынша, әр түрлі шамаларға ие болады. Соқтығысу нәтижесінен бағыты жағынан, модулі жағынан үздіксіз өзгереді. Мысалы, екі молекуланың соқтығысуын қарастырайық.
– газ молекуланың жылдамдықтары өзгеріп отырады. Бағыты бойынша, модулі бойынша, әр түрлі шамаларға ие болады. Соқтығысу нәтижесінен бағыты жағынан, модулі жағынан үздіксіз өзгереді. Мысалы, екі молекуланың соқтығысуын қарастырайық.
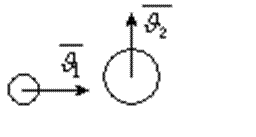 |
1-cурет
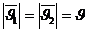
 |
2-сурет

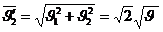
Екі молекуланың соқтығысу кезіндегі жылдамдықтардың өзгеретінің қарастырдық. Соқтығысу нәтижесінде молекулалардың жылдамдығы өзгереді.
Газ молекуласының жылдамдықтары бойынша таралуын 1859ж. Д.К. Максвелл қарастырған. Максвелл таралу функция деген функцияның түрін анықтап, молекулалардың жылдамдықтары бойынша таралуын ашқан. Газдағы жылдамдықтардың модулі нөлден шексіздікке дейін оны 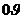 осі арқылы кескіндесек, онда барлық молекулалардың жылдамдықтары осы осьте жатады.
осі арқылы кескіндесек, онда барлық молекулалардың жылдамдықтары осы осьте жатады.
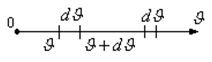 |

3-сурет
Мұндағы 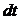 – интервалдың ені,
– интервалдың ені, 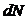 – жылдамдықтары осы интервалда жататын молекулалар саны.
– жылдамдықтары осы интервалда жататын молекулалар саны.
Жылдамдықтары интервалда жататын молекулалар санын табу үшін Максвелл шарт қойды (9.4-сурет). Ол үшін жылдамдықтар кеңістігін қарастырды.
 |
4-сурет
Бір нүктеден (0) барлық молекулалардың жылдамдықтарын көрсетсек, онда әрбір кеңістіктің нүктесі бір жылдамдыққа сәйкес келеді. Мұндай кеңістікті жылдамдықтар кеңістігі деп атайды. Осы кеңістікте параллелепипед қарастырайық.

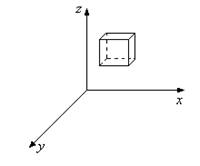
5-сурет
Параллелепипедтің қабырғалары келесі 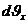 ,
, 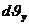 ,
, 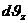 , параллелепипедтің көлемі өте аз (9.5-сурет) және келесіні анықтаймыз:
, параллелепипедтің көлемі өте аз (9.5-сурет) және келесіні анықтаймыз:
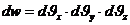 (1)
(1)
Мұндағы 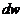 – өте аз көлем.
– өте аз көлем.
Бұл параллелепипедтің көлемі физика мағынасында өте аз болу керек. Бұл көлемге бір молекулаларды жылдамдық нүктелері кіреді, басқа молекулалардікі шығып отырады.
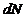 – нүктелер саны. Ол өзгеріп отырады, бірақ та молекулалардың қозғалысы үздіксіз.
– нүктелер саны. Ол өзгеріп отырады, бірақ та молекулалардың қозғалысы үздіксіз.
Нүктелердің орташа мәнін көлемге бөлеміз:
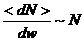 (2)
(2)
мұнда 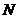 – барлық молекулалар саны,
– барлық молекулалар саны, 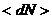 – нүктелердің орташа мәні-кездейсоқ, тұрақты шама.
– нүктелердің орташа мәні-кездейсоқ, тұрақты шама.
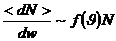 (3)
(3)
Мұндағы 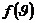 – пропорционалдық коэффициент.
– пропорционалдық коэффициент.
Максвелл пропорционалдық коэффициентті таралу функциясы деп атаған.
Газдың молекулалары хаосты қозғалу кезінде жердің гравитациялық өрісінде, яғни күш өрісінде болады. Сол себептен, газ молекулалары біріншіден хаосты қозғалыс, екіншіден жердің тартылу өрісінен болғандықтан газ белгілі бір таралуды орындайды. Молекулалардың шоғыры өзгереді, қысым да өзгереді.
Қысым байланысы төмендегідей: 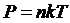 (4)
(4)
Бұл таралуды табу үшін сұйықтардың қысымын, оның терендігіне тәуелді формуланы қолданамыз: 
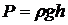 (5)
(5)
(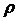 – сұйықтың тығыздығы,
– сұйықтың тығыздығы, 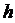 – сұйықтың биіктігі).
– сұйықтың биіктігі).
Бірақ та, осы формуланы осы түрде қолдана алмаймыз. Себебі, газдың тығыздығы тұрақты емес. Жоғары көтерілген сайын ауаның қысымы азаяды.
 ,
, 

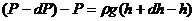
 |
6- сурет
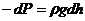
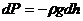 ,
, 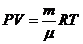
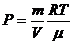 ,
, 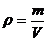 ,
, 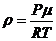
 ,
, 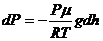
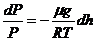 ,
, 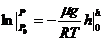
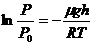
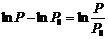
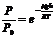
Борометрлік формула келесі: 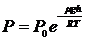 (6)
(6)
Қысымның биіктікке тәуелді кемуін көрсетеді. Әрбір 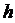 биіктікке белгілі қысым сәйкес келеді. Бұл тәуелділікті қысым өлшеу арқылы биіктікті өлшеуге қолданады, ондай құралды альтиметр деп атайды.
биіктікке белгілі қысым сәйкес келеді. Бұл тәуелділікті қысым өлшеу арқылы биіктікті өлшеуге қолданады, ондай құралды альтиметр деп атайды.
(6) формуладан Больцман таралуын шығарамыз. Ол үшін қысым мен шоғырдың тәуелділігін (4) еске салайық; 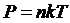

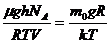 (7)
(7)
(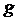 – еркін түсу үдеуі).
– еркін түсу үдеуі).
Температураны тұрақты деп санап және еркін түсу үдеуін тұрақты деп санап (4) және (5) формуласын (6) формуласына қоямыз. 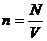
|
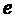 жағдайы:
жағдайы:
(7)
(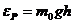 – потенциалдық энергия)
– потенциалдық энергия)
(7) формуладан көрінетіні потенциалдық энергиясы неғұрлым артық болса, бұл таралу ауырлық өріс үшін ғана емес, екі жағдайда болатын, бірінші: хаосты қозғалыста, екінші: қандай өрісте болса да қолданылады.
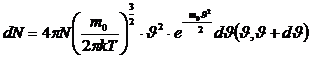
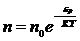 ,
, 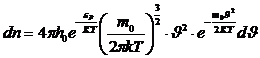
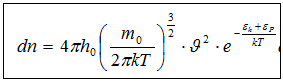 (8)
(8)
(8) формуласы Максвелл–Больцман таралуы
Жылдамдықтардың модулі 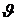 -дан
-дан 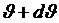 аралығында жатқан және
аралығында жатқан және 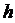 –тан
–тан 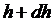 аралығында болатын молекулалардың ықтималдық саны деп атайды.
аралығында болатын молекулалардың ықтималдық саны деп атайды.
Дәріс №.11. Термодинамиканың бірінші бастауы
Термодинамиканың бірінші бастамасы
Дененің ішкі энергиясын өзгертудің екі тәсілі бар: бірінші, жылу мөлшерін беру; екінші, жұмысты арттыру арқылы
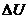
 |  |
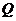
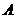
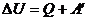
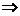
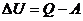
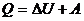
мұндағы 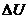 – жүйенің ішкі энергиясының өзгерісі,
– жүйенің ішкі энергиясының өзгерісі, 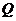 – жүйенің алған жылу мөлшері,
– жүйенің алған жылу мөлшері, 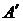 – жүйенің үстіне сыртқы күштердің жасаған жұмысы.
– жүйенің үстіне сыртқы күштердің жасаған жұмысы.
Егер 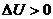 болса, онда ішкі энергия артады, ал егер керісінше
болса, онда ішкі энергия артады, ал егер керісінше 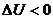 болса, онда ішкі энергия кемиді.
болса, онда ішкі энергия кемиді.
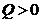 болса, онда жүйе жылу мөлшерін басқа денеге береді. Ал
болса, онда жүйе жылу мөлшерін басқа денеге береді. Ал 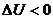 болса, онда жүйе жылу мөлшерін өзіне алады.
болса, онда жүйе жылу мөлшерін өзіне алады.
Термодинамиканың бірінші бастамасы төмендегідей:
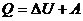 (1)
(1)
Жүйенің алған жылу мөлшерін, оның ішкі энергиясының өсімшесіне және жүйенің сыртқы күштерге қарсы жасалған жұмысына кетеді.
Егер жүйе бір күйден басқа күйлерге ауысып бастапқы күйге қайтып келсе, онда ішкі энергияның өзгерісі нөлге тең (19.1) формуласынан 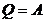 , ешқашан жұмыс жүйе мөлшерінен артық болмайды, ал кем болуы мүмкін.
, ешқашан жұмыс жүйе мөлшерінен артық болмайды, ал кем болуы мүмкін.
Бірінші текті мәңгілік двигатель іске асуы мүмкін емес. Себебі жұмыс ешқашан жылу мөлшерінен артық болмайды.
1. Изотермалық процесс:
|
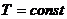
(2)
 (2)
(2)
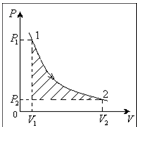
1-сурет
Егер газдың температурасы тұрақсыз өзгермесе, онда оның берілген массасы үшін газ қысымының көлемге көбейтіндісі тұрақты (20.1-сурет).
Термодинамиканың бірінші бастамасы: 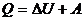
Дифференциал аз шамалар үшін термодинамиканың бірінші бастамасы былай жазылады: 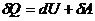 (20.2)
(20.2)
Жұмысты көлем бойынша интегралдаймыз: 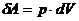
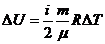 – идеал газдың ішкі энергиясының теңдеуі
– идеал газдың ішкі энергиясының теңдеуі
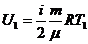
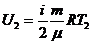 ,
, 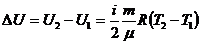
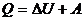 ,
, 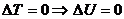
|
(3)
(3) изотермалық процесте жүйеге берілген жылу мөлшері жүйенің атқаратын жұмысына тең.
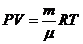 – күй теңдеуі,
– күй теңдеуі, 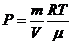
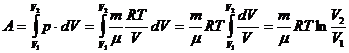
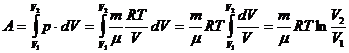
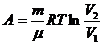 (20.4),
(20.4), 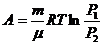 (4)
(4) 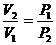
2. Изохоралық процесс:
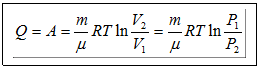
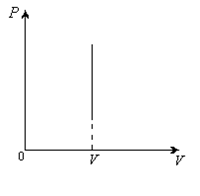 2-сурет
2-сурет
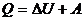 ,
, 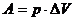
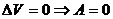 , (
, (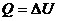 ),
), 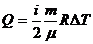
|
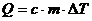
Дәріс №12. Термодинамиканың екінші бастауы.
Термодинамиканың екінші бастамасының негізін қалаушысы болып француз физигі және инженері Сади Карно саналады. 1824 жылы Карно трактат жазып шығарды. «Оттың қозғаушы күші және ол күшті дамыту қабілеті бар машиналар туралы» деп атады.
Осы кезде көптеген жылулық машиналар пайда болды. Бірақ олардың пайдалы әсер коэффициенті өте аз болған, практикада оларды неге тәуелділігін және олардың арттыру жолын іздеу қажеттігі пайда болды. Бұл мәселені Карно шешуге тырысқан, бірақ Карно кейбір қателіктер жіберген. Сондықтан Карно шешімін практикалық дүниеге қолданбады.
Термодинамиканың II бастамасының пастулаты:
1. Томсон анықтамасы: нәтижесі жалғыз-ақ жылулық резервуардан алған жылу мөлшерін жұмысқа айналдыратын дөңгелек процестің іске асуы мүмкін емес.
2.Макс Планк анықтамасы: нәтижесі жалғыз-ақ жылулық резервуардың сууы арқылы жүк көтеретін периодты жылу машинасы іске асуы мүмкін емес.
3. Клаузиус анықтамасы: жылу салқынырақ денеден жылырақ денеге өздігінен ауысуы мүмкін емес.
4. Анықтамасы: екінші текті мәңгілік двигатель іске асуы мүмкін емес. 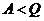 ,
, 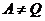 .
.
Қайтымды процесс дегеніміз ол егер термодинамикалық жүйе кейбір өзгерістерден кейін бір күйден екінші күйге өтіп, екінші күйден бастапқы күйіне оралса және қоршаған ортада басқа денелерде ол ауысуда ешқандай өзгеріс қалтырмаса (із қалтырмаса), егер мұндай шарт орындалмаса, онда процесс (цикл) қайтымсыз болады (егер басқа денелерде өзгерістер болса).
Мысалға, математикалық маятниктің қозғалысын алсақ, оның қозғалысы қайтымсыз процесс болады. Себебі, ауаның кедергі күші бар.
Әрбір изопроцестер – қайтымды және оған адиабаталық процестер жатады.
Көптеген циклдардың ішінен жылулық машинаның ПӘК-ін арттыру мәселесін зерттегенде, Карно ең тиімді цикл тапқан. Жұмыстық зат ретінде идеал газ алынған.
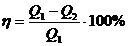 (1),
(1), 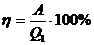 (26.2)
(26.2)
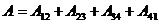 ,
, 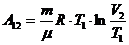
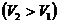
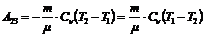
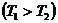
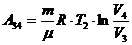
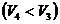
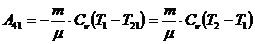
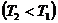
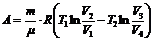 ,
, 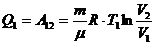
(1) теңдеуге мәндерін қоямыз:
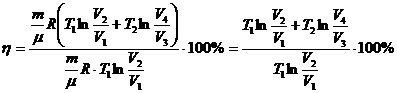
Циклдің тұйықталу шартын қолдану үшін, Пуассон теңдеулерін жазамыз:
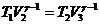 ,
, 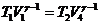 ,
, 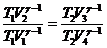
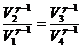
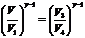
Циклдің тұйықталған шарты:
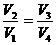 ,
, 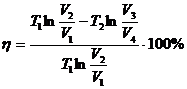
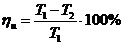 Мұндағы
Мұндағы 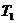 – қыздырғыштың температурасы,
– қыздырғыштың температурасы, 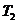 – суытқыштың температурасы.
– суытқыштың температурасы.
Дәріс №13 Процестердің тасымалдауы.
Молекулалардың орнын бір мәнді сипаттайтын тәуелсіз координаталар жиынтығын еркін дәрежелі саны деп атаймыз.
(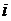 – еркін дәреже саны)
– еркін дәреже саны)
Бір атомды газ үшін: 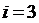
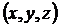
Теорема: (Кинетикалық энергияның біркелкі таралуы бойынша теорема келесі). Кез-келген дәрежеге термодинамикалық тепе-теңдік күйге бірдей кинетикалық энергия келеді: 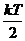
Хаосты қозғалыстағы газдың молекулалары бір-бірімен соқтығысу нәтижесінде траекториялары сынған сызық арқылы белгіленеді.
Еркін жүру жолы дегеніміз ол молекуланың екі көрші соқтығысулар аралығында өткен жолы (15.1-сурет).
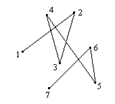 |
1-сурет
Молекуланың еркін жүру жолының орташа мәні келесі формуламен анықталады:
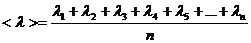 (1)
(1)
(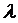 – еркін жүру жолы,
– еркін жүру жолы, 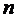 – газдың молекулалар шоғыры (концентрация))
– газдың молекулалар шоғыры (концентрация))
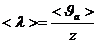 (2),
(2), 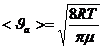
( –1секундта молекуланың соқтығысу саны)
–1секундта молекуланың соқтығысу саны)
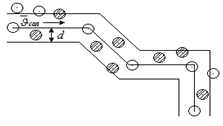
Молекуланың эффективті диаметрі – ол молекуланың соқтығысу кезіндегі ең кіші ара қашықтығы (центрлерінің аралығының ең кіші мәні).
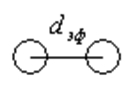 2-cурет
2-cурет
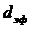 – молекуланың эффективті диаметрі.
– молекуланың эффективті диаметрі.
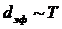 (температураға тәуелді).
(температураға тәуелді).
Температура артқанда молекуланың энергиясы артады, яғни молекуланың эффективті диаметрі кемиді. Бір секунд аралықтада энергия артады, эффективті диаметрі кемиді. Бір секунд аралығында молекуланың соқтығысу санын есептейтін формуланы шығару.
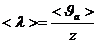
 3-сурет
3-сурет
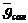 – салыстырмалы жылдамдық
– салыстырмалы жылдамдық
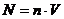 ,
, 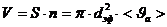 ,
, 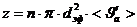 (3)
(3)
Нақты жағдайда газдың барлық молекулары хаосты қозғалыс жасайды. Соны ескеріп (3) формулаға түзету кіргіземіз.
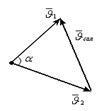 | |||
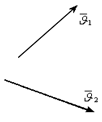 | |||
.4-сурет
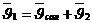 ,
, 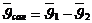 ,
, 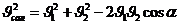
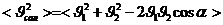 ,
, 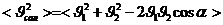 ,
, 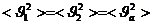 ,
, 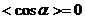 ,
, 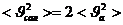 ,
, 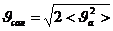
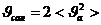
|
(1 (4)
(4) формуласы бір секунд ішінде молекулалардың соқтығысуын анықтайды.
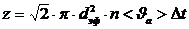 (5)
(5)
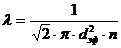 (6)
(6)
(6) молекуланың еркін жүру жолының орташа мәнін анықтайтын формула.
(12.1) теңдеуінен молекулалар шоғырын анықтаймыз:
|
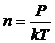
(7)
(7) газ күйінің параметрі арқылы анықтайтын формула және де осы формула 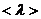 газ қысымына тәуелді екенін көрсетеді:
газ қысымына тәуелді екенін көрсетеді: 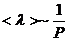 . Егер қысым артса,
. Егер қысым артса, 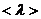 кемиді. Егер қысым кемісе,
кемиді. Егер қысым кемісе, 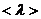 артады.
артады.
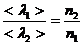
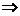
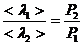
Бұл тәуелділік келесі жағдайға келіп тіреу мүмкін, егер қысымды кемітсе, 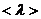 артады да ыдыстың сипаттамалы өлшемімен шамалас болады.
артады да ыдыстың сипаттамалы өлшемімен шамалас болады.
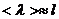 мұндағы
мұндағы 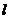 – ыдыстың сипаттама өлшемі.
– ыдыстың сипаттама өлшемі.
Сиретілген газдың күйін вакуум деп аталады.
Диффузия – бір зат молекулаларының басқа зат молекулаларының арасына өзара кіруі.
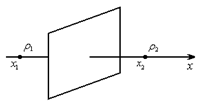 |
5-сурет
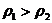
|
(8)
(8) формуласы Фик заңы.
Мұндағы 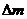 – тасымалданған масса,
– тасымалданған масса, 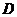 – диффузия коэффициенті,
– диффузия коэффициенті, 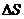 – тасымалдау бағытына перпендикуляр алынған аудан,
– тасымалдау бағытына перпендикуляр алынған аудан, 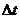 – уақыт аралығы,
– уақыт аралығы, 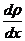 – тығыздықтың коэффициентінің градиенті, «–» – кему бағытын көрсетеді.
– тығыздықтың коэффициентінің градиенті, «–» – кему бағытын көрсетеді.
Хаосты қозғалыс нәтижесінде газдың молекулалары бірінші қабатынан екінші қабатқа ауысады. Егер газ ағынындағы жылдамдық қабаттан қабатқа өзгертіп болса, онда қатар жатқан екі қабаттың арасындағы шекарада ішкі үйкеліс күші әсер ететін болады.
|
мұндағы 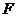 – газдың немесе сұйықьың қабатының арасындағы ішкі үйкеліс күші,
– газдың немесе сұйықьың қабатының арасындағы ішкі үйкеліс күші, 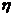 (эта) – тұтқырлық немесе ішкі үйкеліс коэффициенті,
(эта) – тұтқырлық немесе ішкі үйкеліс коэффициенті, 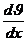 – жылдамдықтың градиенті,
– жылдамдықтың градиенті, 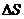 – қабырғаға параллель аудан.
– қабырғаға параллель аудан.
Молекулалық кинетикалық көз қараста кинетикалық заңдарын шығару, яғни газ қозғалысының заңын шығару.
Тасымалданған құбылыстары диффузия, ішкі үйкеліс және жылу өткізгіштік негізі бірдей болғандықтан, екі нүкте молекулаларының хаосты қозғалысы. Бірдей заңдылықтарда өтеді, яғни олардың заңдылықтары бірдей болғандықтан жалпы тасымалдау теңдеуін шығаруға болады.
Дәріс №14.Нақтыгаздар.
Мұндағы 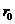 –молекулалардың өзара тепе–теңдік күйіне сәйкес қашықтық,
–молекулалардың өзара тепе–теңдік күйіне сәйкес қашықтық, 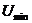 – заттың қандай агрегаттық күйде болатынын көрсетеді.
– заттың қандай агрегаттық күйде болатынын көрсетеді.
1.Төмен температурада потенциалдық энергияның таңбасы теріс 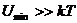 , онда заттың күйіқатты болады.олардың молекулалары бір-біріне тартылыс күш әсерінен үлкен аралыққа орын ауыстырмайды. Сондықтан олар өздерінің тепе-теңдік күйлерінің маңында тербеліс жасайды.
, онда заттың күйіқатты болады.олардың молекулалары бір-біріне тартылыс күш әсерінен үлкен аралыққа орын ауыстырмайды. Сондықтан олар өздерінің тепе-теңдік күйлерінің маңында тербеліс жасайды.
2. Температура артады 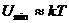 , онда зат сұйық күйінде болады. Жылулық қозғалыс әсерінен молекулалар кеңістікте орын ауыстырады. Бірақ
, онда зат сұйық күйінде болады. Жылулық қозғалыс әсерінен молекулалар кеңістікте орын ауыстырады. Бірақ 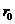 ара қашықтықтан алыстап кетуге мүмкіндіктері жоқ.
ара қашықтықтан алыстап кетуге мүмкіндіктері жоқ.
3. Температура жоғарлағанда, яғни 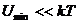 . Зат газ тәріздес күйінде болады. Молекулалар хаосты жылулық қозғалыста болады. Оның әсерінен газ молекулалары
. Зат газ тәріздес күйінде болады. Молекулалар хаосты жылулық қозғалыста болады. Оның әсерінен газ молекулалары 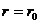 ара қашықтыққа жақындауы мүмкін емес.
ара қашықтыққа жақындауы мүмкін емес.
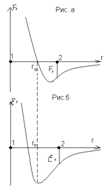
1-сурет
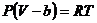 .
. 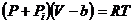 (1),
(1), 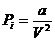
1 моль нақты газ үшін күй теңдеуі:
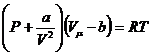 (2),
(2), 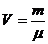 ,
, 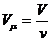
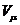 = 1 моль газ үшін көлем, мольдік көлем.
= 1 моль газ үшін көлем, мольдік көлем.
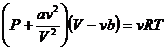
Ван-дер-Ваальс теңдеуі:
|
(3)
Нақты газдың изотермаларын зерттеу үшін температураның кез-келген шамасында Ван-дер-Ваальс теңдеуін (1 моль үшін) өзгеріске келтіреміз.
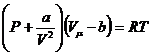 ,
, 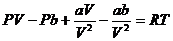 ,
,
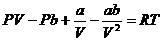 (33.1)
(33.1)
(33.1) теңдеуін 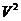 -ге бөлеміз.
-ге бөлеміз.
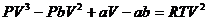 ,
, 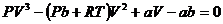
Бұл теңдеу көлемге қатысты 3 дәрежедегі (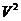 ) теңдеу. Оның 3 түбірі болады: 1) бәрі нақты; 2) бірі нақты екеуі жалған.
) теңдеу. Оның 3 түбірі болады: 1) бәрі нақты; 2) бірі нақты екеуі жалған.
Бірақ жалған түбірлері физикалық мағынаға ие болмайды.
Ван–дер–Ваальс нақты газ изотермаларын зерттеу үшін қысымның көлемге тәуелді графиктерін әртүрлі температурада келтірсек, түрі келесі: 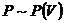
Нақты газдың изотермалары:
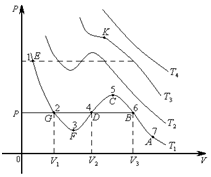
2-сурет
мұндағы  ,
,  – газдың сығылу учаскесі,
– газдың сығылу учаскесі, 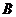 ,
, 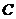 – аса қаныққан бу,
– аса қаныққан бу, 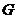 ,
, 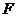 – аса созылған сұйық,
– аса созылған сұйық, 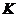 – нүкте.
– нүкте.
1. Температура жоғарлаған сайын изотерма артады 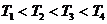 .
.
2. Төмендеу температурада изотермаларда иірілу немесе S тәріздес учаске пайда болады.
3. Температура артқан сайын иірілу азаяды. Бұл жағдайларда бір қысымға үш көлемнің мәні сәйкес келеді.
4. Температура әрі артқан сайын 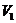 ,
, 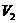 ,
, 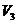 көлемдері өзаралық жақындайды және әрбір затқа белгілі температурада бір нүктеге айналады. Ол нүкте кризистік нүкте деп аталады.
көлемдері өзаралық жақындайды және әрбір затқа белгілі температурада бір нүктеге айналады. Ол нүкте кризистік нүкте деп аталады.
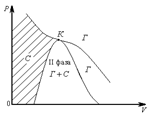
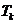 – кризистік температура,
– кризистік температура, 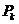 – кризистік қысым,
– кризистік қысым, 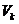 – кризистік көлем, 7-6 – газдың изотермиялық сығылу учаскесі, 2-1 – сұйықтың изотермиялық сығылу учаскесі. Газды 6-2 күйге жеткізгенде қысым өзгермейді, газдың сұйыққа айналуы басталады. Бұл кезде газ (бу) өзінің сұйығымен тепе-теңдікте болады. Ондай буды қаныққан бу деп атайды. Оған сәйкес келетін қысымды қаныққан буының қысымы деп аталады.
– кризистік көлем, 7-6 – газдың изотермиялық сығылу учаскесі, 2-1 – сұйықтың изотермиялық сығылу учаскесі. Газды 6-2 күйге жеткізгенде қысым өзгермейді, газдың сұйыққа айналуы басталады. Бұл кезде газ (бу) өзінің сұйығымен тепе-теңдікте болады. Ондай буды қаныққан бу деп атайды. Оған сәйкес келетін қысымды қаныққан буының қысымы деп аталады.
3-сурет
1. 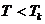 газ сығылу арқылы зат сұйық күйге айналады.
газ сығылу арқылы зат сұйық күйге айналады.
2. 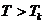 газ сығылу арқылы зат сұйық күйге айналмайды. Бұл күйде газ тек газ күйінде болады.
газ сығылу арқылы зат сұйық күйге айналмайды. Бұл күйде газ тек газ күйінде болады.
 |
4-сурет
мұндағы 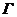 – газ,
– газ, 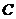 – сұйық,
– сұйық, 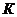 – кризистік нүкте.
– кризистік нүкте.
 Кризистік күйді бақылау үшін кішішыны ішіне зат енгізіледі. Ауаны қайнату арқылыішінен жойылады. Ампула ішінде сұйық өзінің буымен тепе-теңдік күйде болады. Тәжірибе көмірқышқылымен өте жақсы көрінеді. Көмірқышқылының
Кризистік күйді бақылау үшін кішішыны ішіне зат енгізіледі. Ауаны қайнату арқылыішінен жойылады. Ампула ішінде сұйық өзінің буымен тепе-теңдік күйде болады. Тәжірибе көмірқышқылымен өте жақсы көрінеді. Көмірқышқылының 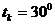 ,
, 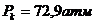 . Эфирдің
. Эфирдің 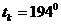 ,
,
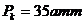 . Содан кейін ампуланы пеш ішіне орналастырылып
. Содан кейін ампуланы пеш ішіне орналастырылып
қыздырылады. Кризистік температура температурадын кем
болғанда сұйық бетіндегі мениск айқын көрінеді. Температура
жағарлаған сайын және кризистікке жақындаған сайын ол 5-сурет
үздіксіз кемиді. Жазыққа айналады кризистік температураға
жеткенде екі фаза арасындағы айырмашылық зат кенет, мүлдем жоғалады. Зат біртекті күйде болады. Бұл күйде температура артқан сайын қала береді, ал суыған кезде кері. Сол күйлерді өтеді, кризистік заттың сұйығы және бу арасындағы ешқандай айырмашылық болмайды.
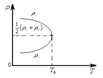 |
.5-сурет
Кризистік нүктеде 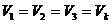 ,
, 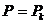
|
|
мұндағы 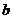 – жөндеу коэффициенті (кестеден қарау).
– жөндеу коэффициенті (кестеден қарау).
Идеал газдың ішкі энергиясы тек молекулалардың кинетикалық энергиясының қосындысы ретінде саналады. Потенциалдық энергиясын ескермейміз. Сонымен, идеал газдың ішкі энергиясын келесіде есептедік:
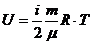
 2018-01-08
2018-01-08 2229
2229