
 Поскольку Поскольку dQ = 0, то первое начало термодинамики примет вид:
Поскольку Поскольку dQ = 0, то первое начало термодинамики примет вид:
для конечного адиабатического процесса  Политропические процессы Политропические процессы 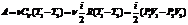  | 26. Второй закон термодинамики. Энтропия. Закон возрастания энтропии. Теорема Нернста. Энтропия идеального газа. Расчет изменения энтропии при изохорическом, изобарическом и изотермическом процессах. 2 закон термодинамики: Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе. Энтропия - функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы. Закон возрастания энтропии: В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс. Теорема Нернста: изменение энтропии (d S) при любых обратимых изотермических процессах, совершаемых между двумя равновесными состояниями при температурах Т, приближающихся к абсолютному нулю, стремится к нулю:  Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует: Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:  , если проинтегрировать, то полное изменение энтропии в этом процессе: , если проинтегрировать, то полное изменение энтропии в этом процессе:  Изменение энтропии при квазистатическом изобарном процессе равно Изменение энтропии при квазистатическом изобарном процессе равно  . В случае, если изобарный процесс происходит в идеальном газе, то . В случае, если изобарный процесс происходит в идеальном газе, то 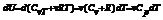 , следовательно, изменение энтропии можно выразить как , следовательно, изменение энтропии можно выразить как 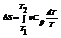 . Если пренебречь зависимостью . Если пренебречь зависимостью  от температуры, то от температуры, то  . . | 27. Цикл Карно и его к.п.д. для идеального газа и произвольного рабочего тела.Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов. Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно  . Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику . Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику  . Отсюда коэффициент полезного действия тепловой машины Карно равен . Отсюда коэффициент полезного действия тепловой машины Карно равен  . . | 28. Барометрическая формула. Распределение Больцмана. Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру  и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения  одинаково), барометрическая формула имеет следующий вид: одинаково), барометрическая формула имеет следующий вид:  , где p — давление газа в слое, расположенном на высоте h, , где p — давление газа в слое, расположенном на высоте h,  — давление на нулевом уровне — давление на нулевом уровне  , M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул , M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул 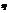 (или плотность газа) убывает с высотой по тому же закону: (или плотность газа) убывает с высотой по тому же закону: |  , где m — масса молекулы газа, k — постоянная Больцмана. Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871. Согласно распределению Больцмана среднее число частиц с полной энергией Ei равно , где m — масса молекулы газа, k — постоянная Больцмана. Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871. Согласно распределению Больцмана среднее число частиц с полной энергией Ei равно  , где Ni — кратность состояния частицы с энергией Ei — число возможных состояний частицы с энергией Ei. , где Ni — кратность состояния частицы с энергией Ei — число возможных состояний частицы с энергией Ei. |
29. Закон Максвелла распределения по скоростям и абсолютным значениям скоростей. Средняя, средняя квадратичная и наиболее вероятная скорости молекул. Закон Максвелла-Больцмана — распределение молекул газа по координатам и скоростям при наличии произвольного потенциального силового поля. При рассмотрении распределения Максвелла-Больцмана бросается в глаза важное свойство - его можно представить как произведение двух множителей:  . Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d v, то на каждый интервал скорости будет приходиться некоторое число молекул d N(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул d N(v)/N, скорости которых лежат в интервале от v до v+ d v, т. е. . Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d v, то на каждый интервал скорости будет приходиться некоторое число молекул d N(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул d N(v)/N, скорости которых лежат в интервале от v до v+ d v, т. е.  , откуда , откуда  . Применяя методы теории вероятностей. Максвелл нашел функцию f(v) ≈ закон о распределеня молекул идеального газа по скоростям: . Применяя методы теории вероятностей. Максвелл нашел функцию f(v) ≈ закон о распределеня молекул идеального газа по скоростям:  . Наиболее вероятная скорость, . Наиболее вероятная скорость,  — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению  . Чтобы найти её, необходимо вычислить . Чтобы найти её, необходимо вычислить  , приравнять её нулю и решить относительно v: , приравнять её нулю и решить относительно v:  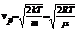 . Средняя скорость . Средняя скорость  , подставляя , подставляя  и интегрируя, мы получим и интегрируя, мы получим  . Среднеквадратичная скорость . Среднеквадратичная скорость  .Подставляя f(v) и интегрируя, мы получим .Подставляя f(v) и интегрируя, мы получим  . . | 30. Столкновения молекул. Эффективное сечение молекулы. Число столкновений молекулы в единицу времени. Длина свободного пробега молекулы. Изменение направления движения молекулы на заметный угол под действием другой молекулы называют столкновением молекул или рассеянием. Так как столкновения молекул являются случайными событиями, то результаты столкновений могут быть предсказаны лишь вероятностно. Вероятность столкновения описывают с помощью поперечного сечения σ (или эффективной площади сечения или сечения рассеяния). Эффективное сечение — площадь поперечного сечения цилиндра, покрываемого молекулой, такого, что молекулы, через которые он проходит, провзаимодействуют с пробной молекулой. То есть  , где , где  и и  — радиус пробной молекулы и полевых молекул. Но имеются отклонения от этого простого соотношения. Длина свободного пробега молекулы — это среднее расстояние (обозначаемое — радиус пробной молекулы и полевых молекул. Но имеются отклонения от этого простого соотношения. Длина свободного пробега молекулы — это среднее расстояние (обозначаемое  ), которое частица пролетает за время свободного пробега от одного столкновения до следующего. Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега ( ), которое частица пролетает за время свободного пробега от одного столкновения до следующего. Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега ( ). Величина ). Величина  является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры. является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.  , где , где  — эффективное сечение молекулы, n — концентрация молекул. Так как за 1 с молекула в среднем проходит путь, который равен средней арифметической скорости <v>, и если < z > — среднее число столкновений, которые одна молекула газа делает за 1 с, то средняя длина свободного пробега будет — эффективное сечение молекулы, n — концентрация молекул. Так как за 1 с молекула в среднем проходит путь, который равен средней арифметической скорости <v>, и если < z > — среднее число столкновений, которые одна молекула газа делает за 1 с, то средняя длина свободного пробега будет  Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d (рис. 2). Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра: Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d (рис. 2). Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:  , где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений , где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений  . Расчеты показывают, что при учете движения других молекул . Расчеты показывают, что при учете движения других молекул  . Тогда средняя длина свободного пробега . Тогда средняя длина свободного пробега  , т. е. < l > обратно пропорциональна концентрации n молекул. С другой стороны, p=nkT. Значит, , т. е. < l > обратно пропорциональна концентрации n молекул. С другой стороны, p=nkT. Значит,  . . | 31. Диффузия в газах. Вязкость газов. Теплопроводность газов. Вывод коэффициентов диффузии, вязкости, теплопроводности. Вывести систему, представляющую собой идеальный газ, из равновесного состояния можно, например, нагрев одну часть газа, то есть нарушить тепловое равновесие. Если газ после этого предоставить самому себе, то через некоторое время температура снова станет одинаковой во всех частях газа. Это выравнивание происходит благодаря непрерывному тепловому движению молекул. В нагретой части больше быстрых молекул, имеющих большую тепловую энергию, чем в других частях газа, поэтому быстрые молекулы переходят туда, где их меньше, таким образом, их число становится равным повсюду. Одновременно происходит перемещение молекул и в нагретую область, благодаря соударениям, так что число частиц в единице объёма в среднем не изменяется. Происходит только перенос энергии из той части газа, где она больше, туда, где она меньше. Этот процесс называется теплопроводностью. Если систему вывести из равновесия, добавив примесь другого газа, так, чтобы при одинаковых во всём объёме давлении и температуре, концентрация примеси в одной части была выше, чем во всех других, то спустя определённое время система перейдёт в равновесное состояние за счёт перемещения молекул примеси из области с большей концентрацией в область с меньшей концентрацией. В данном процессе, который называется диффузией, происходит перенос массы примеси. Время релаксации системы в этом случае не равно времени релаксации системы, стремящейся к тепловому равновесию. Равновесие газа может быть нарушено, если одной из его частей сообщена скорость, отличная от скорости течения соседних частей. В этом случае через некоторое время, благодаря переносу импульса упорядоченного движения от более быстрых слоёв к менее быстрым, скорости слоёв выравниваются. Этот процесс называется вязкостью. Все эти процессы можно рассматривать как явления переноса, подходя к их изучению с формальной стороны одинаково: выделяя переносимую величину, выделяя причину переноса, вводя уравнение переноса и времена релаксации. Зависимость коэффициента диффузии от температуры в простейшем случае выражается законом Аррениуса:  , где D — коэффициент диффузии [ {м²}/{сек} ]; , где D — коэффициент диффузии [ {м²}/{сек} ];  — энергия активации [Дж]; k — постоянная Больцмана; T — температура — энергия активации [Дж]; k — постоянная Больцмана; T — температура 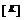 . Коэффициент теплопроводности газов определяется формулой . Коэффициент теплопроводности газов определяется формулой 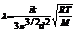 , где: i — сумма поступательных и вращательных степеней свободы молекул (для двухатомного газа i=5, для одноатомного i=3), k — постоянная Больцмана, M — молярная масса, T — абсолютная температура, d — эффективный диаметр молекул, R — универсальная газовая постоянная. Из формулы видно, что наименьшей теплопроводностью обладают тяжелые одноатомные (инертные) газы, наибольшей — легкие многоатомные (что подтверждается практикой, максимальная теплопроводность из всех газов — у водорода, минимальная — у радона, из не радиоактивных газов - у ксенона). Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры: , где: i — сумма поступательных и вращательных степеней свободы молекул (для двухатомного газа i=5, для одноатомного i=3), k — постоянная Больцмана, M — молярная масса, T — абсолютная температура, d — эффективный диаметр молекул, R — универсальная газовая постоянная. Из формулы видно, что наименьшей теплопроводностью обладают тяжелые одноатомные (инертные) газы, наибольшей — легкие многоатомные (что подтверждается практикой, максимальная теплопроводность из всех газов — у водорода, минимальная — у радона, из не радиоактивных газов - у ксенона). Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:  , где: μ = динамическая вязкость в (Па·с) при заданной температуре T, μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0, T = заданная температура в Кельвинах, T0 = контрольная температура в Кельвинах, C = постоянная Сазерленда для того газа, вязкость которого требуется определить. , где: μ = динамическая вязкость в (Па·с) при заданной температуре T, μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0, T = заданная температура в Кельвинах, T0 = контрольная температура в Кельвинах, C = постоянная Сазерленда для того газа, вязкость которого требуется определить. |
32. Реальные газы. Уравнение состояния реальных газов. Изотермы реальных газов. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:  , где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Чтобы подробнее установить условия, когда газ может превратиться в жидкость и наоборот, простых наблюдений за испарением или кипением жидкости недостаточно. Надо внимательно проследить за изменением давления и объёма реального газа при разных температурах. Медленно будем сжимать газ в сосуде с поршнем, например сернистый ангидрид (SO2). Сжимая его, мы выполняем над ним работу, вследствие чего внутренняя энергия газа увеличится. Когда мы хотим, чтобы процесс происходил при постоянной температуре, то сжимать газ надо очень медленно, чтобы теплота успевала переходить от газа в окружающую среду. , где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Чтобы подробнее установить условия, когда газ может превратиться в жидкость и наоборот, простых наблюдений за испарением или кипением жидкости недостаточно. Надо внимательно проследить за изменением давления и объёма реального газа при разных температурах. Медленно будем сжимать газ в сосуде с поршнем, например сернистый ангидрид (SO2). Сжимая его, мы выполняем над ним работу, вследствие чего внутренняя энергия газа увеличится. Когда мы хотим, чтобы процесс происходил при постоянной температуре, то сжимать газ надо очень медленно, чтобы теплота успевала переходить от газа в окружающую среду. | Выполняя этот опыт, можно заметить, что сначала при большом объёме давление с уменьшением объёма увеличивается согласно закону Бойля — Мариотта. В конце концов, начиная с какого-то значения, давление не будет изменяться, несмотря на уменьшение объёма. На стенках цилиндра и поршня образуются прозрачные капли. Это означает, что газ начал конденсироваться, то есть переходить в жидкое состояние. Продолжая сжимать содержимое цилиндра, мы будем увеличивать массу жидкости под поршнем и соответственно, будем уменьшать массу газа. Давление, которое показывает манометр, будет оставаться постоянным до тех пор, пока всё пространство под поршнем не заполнит жидкость. Жидкости мало сжимаемы. Поэтому дальше, даже при незначительном уменьшении объёма, давление быстро будет возрастать. Поскольку весь процесс происходит при постоянной температуре T, кривую, что изображает зависимость давления р от объёма V, называют изотермой. При объёме V1 начинается конденсация газа, а при объёме V2 она заканчивается. Если V > V1 то вещество будет в газообразном состоянии, а при V < V2 — в жидком. Опыты показывают, что такой вид имеют изотермы и всех других газов, если их температура не очень высокая. | В этом процессе, когда газ превращается в жидкость при изменении его объёма от V1 к V2, давление газа остаётся постоянным. Каждой точке прямолинейной части изотермы 1—2 соответствует равновесие между газообразным и жидким состояниями вещества. Это означает, что при определённых T и V количество жидкости и газа над ней остаётся неизменным. Равновесие имеет динамический характер: количество молекул, которые покидают жидкости, в среднем равняется количеству молекул, которые переходят из газа в жидкость за одно и то же время. Также существует такое понятие как критическая температура, если газ находится при температуре выше критической (индивидуальна для каждого газа, например для углекислого газа примерно 304 К), то его уже невозможно превратить в жидкость, какое бы давление к нему не прилагалось. Данное явление возникает вследствие того, что при критической температуре силы поверхностного натяжения жидкости равны нулю. Если продолжать медленно сжимать газ при температуре большей критической, то после достижения им объёма, равного приблизительно четырем собственным объёмам молекул, составляющих газ, сжимаемость газа начинает резко падать. |

 Поскольку Поскольку dQ = 0, то первое начало термодинамики примет вид:
Поскольку Поскольку dQ = 0, то первое начало термодинамики примет вид: Политропические процессы
Политропические процессы 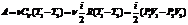

 Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:  , если проинтегрировать, то полное изменение энтропии в этом процессе:
, если проинтегрировать, то полное изменение энтропии в этом процессе:  Изменение энтропии при квазистатическом изобарном процессе равно
Изменение энтропии при квазистатическом изобарном процессе равно  . В случае, если изобарный процесс происходит в идеальном газе, то
. В случае, если изобарный процесс происходит в идеальном газе, то 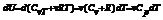 , следовательно, изменение энтропии можно выразить как
, следовательно, изменение энтропии можно выразить как 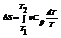 . Если пренебречь зависимостью
. Если пренебречь зависимостью  от температуры, то
от температуры, то  .
.  . Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
. Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику  . Отсюда коэффициент полезного действия тепловой машины Карно равен
. Отсюда коэффициент полезного действия тепловой машины Карно равен  .
.  и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения
и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения  одинаково), барометрическая формула имеет следующий вид:
одинаково), барометрическая формула имеет следующий вид:  , где p — давление газа в слое, расположенном на высоте h,
, где p — давление газа в слое, расположенном на высоте h,  — давление на нулевом уровне
— давление на нулевом уровне  , M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул
, M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул 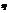 (или плотность газа) убывает с высотой по тому же закону:
(или плотность газа) убывает с высотой по тому же закону:  , где m — масса молекулы газа, k — постоянная Больцмана. Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871. Согласно распределению Больцмана среднее число частиц с полной энергией Ei равно
, где m — масса молекулы газа, k — постоянная Больцмана. Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871. Согласно распределению Больцмана среднее число частиц с полной энергией Ei равно  , где Ni — кратность состояния частицы с энергией Ei — число возможных состояний частицы с энергией Ei.
, где Ni — кратность состояния частицы с энергией Ei — число возможных состояний частицы с энергией Ei.  . Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d v, то на каждый интервал скорости будет приходиться некоторое число молекул d N(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул d N(v)/N, скорости которых лежат в интервале от v до v+ d v, т. е.
. Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d v, то на каждый интервал скорости будет приходиться некоторое число молекул d N(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул d N(v)/N, скорости которых лежат в интервале от v до v+ d v, т. е.  , откуда
, откуда  . Применяя методы теории вероятностей. Максвелл нашел функцию f(v) ≈ закон о распределеня молекул идеального газа по скоростям:
. Применяя методы теории вероятностей. Максвелл нашел функцию f(v) ≈ закон о распределеня молекул идеального газа по скоростям:  . Наиболее вероятная скорость,
. Наиболее вероятная скорость,  — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению
— вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению  . Чтобы найти её, необходимо вычислить
. Чтобы найти её, необходимо вычислить  , приравнять её нулю и решить относительно v:
, приравнять её нулю и решить относительно v: 
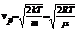 . Средняя скорость
. Средняя скорость  , подставляя
, подставляя  и интегрируя, мы получим
и интегрируя, мы получим  . Среднеквадратичная скорость
. Среднеквадратичная скорость  .Подставляя f(v) и интегрируя, мы получим
.Подставляя f(v) и интегрируя, мы получим  .
.  , где
, где  и
и  — радиус пробной молекулы и полевых молекул. Но имеются отклонения от этого простого соотношения. Длина свободного пробега молекулы — это среднее расстояние (обозначаемое
— радиус пробной молекулы и полевых молекул. Но имеются отклонения от этого простого соотношения. Длина свободного пробега молекулы — это среднее расстояние (обозначаемое  ), которое частица пролетает за время свободного пробега от одного столкновения до следующего. Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (
), которое частица пролетает за время свободного пробега от одного столкновения до следующего. Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега ( ). Величина
). Величина  является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.  , где
, где  — эффективное сечение молекулы, n — концентрация молекул. Так как за 1 с молекула в среднем проходит путь, который равен средней арифметической скорости <v>, и если < z > — среднее число столкновений, которые одна молекула газа делает за 1 с, то средняя длина свободного пробега будет
— эффективное сечение молекулы, n — концентрация молекул. Так как за 1 с молекула в среднем проходит путь, который равен средней арифметической скорости <v>, и если < z > — среднее число столкновений, которые одна молекула газа делает за 1 с, то средняя длина свободного пробега будет  Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d (рис. 2). Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:
Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d (рис. 2). Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:  , где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений
, где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений  . Расчеты показывают, что при учете движения других молекул
. Расчеты показывают, что при учете движения других молекул  . Тогда средняя длина свободного пробега
. Тогда средняя длина свободного пробега  , т. е. < l > обратно пропорциональна концентрации n молекул. С другой стороны, p=nkT. Значит,
, т. е. < l > обратно пропорциональна концентрации n молекул. С другой стороны, p=nkT. Значит,  .
.  , где D — коэффициент диффузии [ {м²}/{сек} ];
, где D — коэффициент диффузии [ {м²}/{сек} ];  — энергия активации [Дж]; k — постоянная Больцмана; T — температура
— энергия активации [Дж]; k — постоянная Больцмана; T — температура 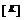 . Коэффициент теплопроводности газов определяется формулой
. Коэффициент теплопроводности газов определяется формулой 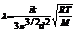 , где: i — сумма поступательных и вращательных степеней свободы молекул (для двухатомного газа i=5, для одноатомного i=3), k — постоянная Больцмана, M — молярная масса, T — абсолютная температура, d — эффективный диаметр молекул, R — универсальная газовая постоянная. Из формулы видно, что наименьшей теплопроводностью обладают тяжелые одноатомные (инертные) газы, наибольшей — легкие многоатомные (что подтверждается практикой, максимальная теплопроводность из всех газов — у водорода, минимальная — у радона, из не радиоактивных газов - у ксенона). Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:
, где: i — сумма поступательных и вращательных степеней свободы молекул (для двухатомного газа i=5, для одноатомного i=3), k — постоянная Больцмана, M — молярная масса, T — абсолютная температура, d — эффективный диаметр молекул, R — универсальная газовая постоянная. Из формулы видно, что наименьшей теплопроводностью обладают тяжелые одноатомные (инертные) газы, наибольшей — легкие многоатомные (что подтверждается практикой, максимальная теплопроводность из всех газов — у водорода, минимальная — у радона, из не радиоактивных газов - у ксенона). Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:  , где: μ = динамическая вязкость в (Па·с) при заданной температуре T, μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0, T = заданная температура в Кельвинах, T0 = контрольная температура в Кельвинах, C = постоянная Сазерленда для того газа, вязкость которого требуется определить.
, где: μ = динамическая вязкость в (Па·с) при заданной температуре T, μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0, T = заданная температура в Кельвинах, T0 = контрольная температура в Кельвинах, C = постоянная Сазерленда для того газа, вязкость которого требуется определить.  , где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Чтобы подробнее установить условия, когда газ может превратиться в жидкость и наоборот, простых наблюдений за испарением или кипением жидкости недостаточно. Надо внимательно проследить за изменением давления и объёма реального газа при разных температурах. Медленно будем сжимать газ в сосуде с поршнем, например сернистый ангидрид (SO2). Сжимая его, мы выполняем над ним работу, вследствие чего внутренняя энергия газа увеличится. Когда мы хотим, чтобы процесс происходил при постоянной температуре, то сжимать газ надо очень медленно, чтобы теплота успевала переходить от газа в окружающую среду.
, где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Чтобы подробнее установить условия, когда газ может превратиться в жидкость и наоборот, простых наблюдений за испарением или кипением жидкости недостаточно. Надо внимательно проследить за изменением давления и объёма реального газа при разных температурах. Медленно будем сжимать газ в сосуде с поршнем, например сернистый ангидрид (SO2). Сжимая его, мы выполняем над ним работу, вследствие чего внутренняя энергия газа увеличится. Когда мы хотим, чтобы процесс происходил при постоянной температуре, то сжимать газ надо очень медленно, чтобы теплота успевала переходить от газа в окружающую среду.  2018-01-08
2018-01-08 1072
1072