Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
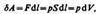
где S — площадь поршня, Sdl=dV— изменение объема системы Таким образом,
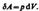 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (52.1):
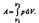
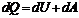
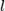 и одна частица массой m в нём. Обозначим скорость движения
и одна частица массой m в нём. Обозначим скорость движения  тогда перед столкновением со стенкой сосуда импульс частицы равен
тогда перед столкновением со стенкой сосуда импульс частицы равен  а после —
а после —  поэтому стенке передается импульс
поэтому стенке передается импульс 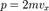 . Время, через которое частица сталкивается с одной и той же стенкой, равно
. Время, через которое частица сталкивается с одной и той же стенкой, равно 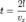 Отсюда следует:
Отсюда следует: 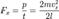 Так как давление
Так как давление 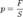 следовательно сила
следовательно сила 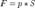 Подставив, получим:
Подставив, получим: 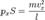 Преобразовав:
Преобразовав: 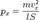 Так как рассматривается кубический сосуд, то
Так как рассматривается кубический сосуд, то  Отсюда:
Отсюда: 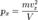 Соответственно,
Соответственно, 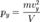 и
и 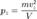 Таким образом, для большого числа частиц верно следующее:
Таким образом, для большого числа частиц верно следующее: 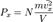 аналогично для осей y и z. Поскольку
аналогично для осей y и z. Поскольку 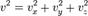 то
то 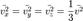 Это следует из того, что все направления движения молекул в хаотичной среде равновероятны. Отсюда
Это следует из того, что все направления движения молекул в хаотичной среде равновероятны. Отсюда 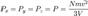 или
или 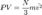 Пусть
Пусть 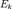 — среднее значение кинетической энергии всех молекул, тогда:
— среднее значение кинетической энергии всех молекул, тогда: 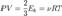 откуда
откуда 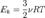 Для одного моля выражение примет вид
Для одного моля выражение примет вид 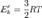
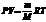 Уравнение Менделеева-Клапейрона
М - масса 1 моля газа,
R = 8,31 - универсальная газовая постоянная.
Законы идеальных газов
1. Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
pV=const при T=const, m=const (7)
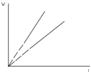
Процесс, протекающий при постоянной температуре, называется изотермическим. Кривая, изображающая зависимость между величинами p и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные тем выше, чем выше температура, при которой происходит процесс (рис. 1).
Уравнение Менделеева-Клапейрона
М - масса 1 моля газа,
R = 8,31 - универсальная газовая постоянная.
Законы идеальных газов
1. Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
pV=const при T=const, m=const (7)
Процесс, протекающий при постоянной температуре, называется изотермическим. Кривая, изображающая зависимость между величинами p и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные тем выше, чем выше температура, при которой происходит процесс (рис. 1).
 Рис. 1. Зависимость давления идеального газа от объема при постоянной температуре
2. Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно:
V=V0(1+αt) при p=const, m=const (8)
Здесь t - температура по шкале Цельсия, V0 - объем газа при 0 oС, α=(1/273) K-1 - температурный коэффициент объемного расширения газа.
Процесс, протекающий при постоянном давлении и неизменной массе газа, называется изобарным. В ходе изобарного процесса для газа данной массы отношение объема к температуре постоянно:
Рис. 1. Зависимость давления идеального газа от объема при постоянной температуре
2. Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно:
V=V0(1+αt) при p=const, m=const (8)
Здесь t - температура по шкале Цельсия, V0 - объем газа при 0 oС, α=(1/273) K-1 - температурный коэффициент объемного расширения газа.
Процесс, протекающий при постоянном давлении и неизменной массе газа, называется изобарным. В ходе изобарного процесса для газа данной массы отношение объема к температуре постоянно:
 V/T=const.На диаграмме в координатах (V,t) этот процесс изображается прямой, называемой изобарой (рис. 2). Рис. 2. Зависимость объема идеального газа от температуры при постоянном давлении
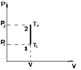
3. Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p=p0(1+αt) при p=const, m=const (9)
V/T=const.На диаграмме в координатах (V,t) этот процесс изображается прямой, называемой изобарой (рис. 2). Рис. 2. Зависимость объема идеального газа от температуры при постоянном давлении
3. Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p=p0(1+αt) при p=const, m=const (9)
 Рис. 3. Зависимость давления идеального газа от температуры при постоянном объеме
Вводя в формулах (8) и (9) термодинамическую температуру T, законам Гей-Люссака и Шарля можно придать более удобный вид:
V=V0(1+αt)=V0[1+α(T-1/α)]=V0αT (10)
p=p0(1+αt)=p0[1+α(T-1/α)]=p0αT (11)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.
Так, при нормальных условиях один моль любого газа занимает объем 22,4 м-3. При одинаковых температуре и давлении любой газ содержит в единице объема одинаковое количество молекул.
При нормальных условиях в 1 м3 любого газа содержится число частиц, называемое числом Лошмидта: NL=2,68·1025 м-3.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pn входящих в нее газов:
p=p1+p2+....+pn Парциальное давление – давление, которое создавал бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре.
Число степеней свободы молекул
Числом степеней свободы материального объекта называют число независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта относительно рассматриваемой системы отсчета. Например, положение материальной точки в пространстве определяется тремя координатами x, y, z, следовательно, материальная точка обладает тремя степенями свободы. Средняя энергия молекул
Рис. 3. Зависимость давления идеального газа от температуры при постоянном объеме
Вводя в формулах (8) и (9) термодинамическую температуру T, законам Гей-Люссака и Шарля можно придать более удобный вид:
V=V0(1+αt)=V0[1+α(T-1/α)]=V0αT (10)
p=p0(1+αt)=p0[1+α(T-1/α)]=p0αT (11)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.
Так, при нормальных условиях один моль любого газа занимает объем 22,4 м-3. При одинаковых температуре и давлении любой газ содержит в единице объема одинаковое количество молекул.
При нормальных условиях в 1 м3 любого газа содержится число частиц, называемое числом Лошмидта: NL=2,68·1025 м-3.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pn входящих в нее газов:
p=p1+p2+....+pn Парциальное давление – давление, которое создавал бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре.
Число степеней свободы молекул
Числом степеней свободы материального объекта называют число независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта относительно рассматриваемой системы отсчета. Например, положение материальной точки в пространстве определяется тремя координатами x, y, z, следовательно, материальная точка обладает тремя степенями свободы. Средняя энергия молекул 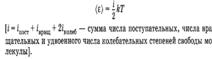
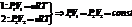 Применение первого закона термодинамики при изохорическом, изобарическом, изотермических процессах
Применение первого закона термодинамики при изохорическом, изобарическом, изотермических процессах
 Этот закон является частным случаем уравнения состояния идеального газа: PV = nRT Изохорический процесс
--закон Ширля
Этот закон является частным случаем уравнения состояния идеального газа: PV = nRT Изохорический процесс
--закон Ширля
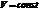 |  | ||
Так как то и,т.е
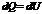
 т.е первое начало термодинамики для изохорического процесса.
т.е первое начало термодинамики для изохорического процесса.

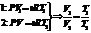 Изобарический процесс зак. Гей-Люссака
Изобарический процесс зак. Гей-Люссака
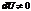
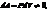 Работа, совершаемая газом, приращение внутренней энергии газа тоже не равно нулю
Работа, совершаемая газом, приращение внутренней энергии газа тоже не равно нулю
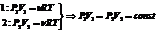 первое начало термодинамики для изобарического процесса
первое начало термодинамики для изобарического процесса 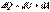
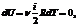 |

Так как T = const, то т. е. dU = 0
т. е. dU = 0 dQ = dA - первое начало термодинамики при изотермическом процессе
|
|

 2018-01-08
2018-01-08 981
981






