Катодну поляризацію можна здійснювати шляхом приєднання конструкції, яку захищають, до негативного полюсу зовнішнього джерела струму або до металу, що має більш електронегативний електродний потенціал. У другому випадку немає потреби у зовнішньому джерелі струму, адже утворюється гальванічний елемент з тим же напрямом струму, тобто захищена деталь стає катодом, а більш електронегативний метал, який називають протектором, – анодом [1].
Схема катодного захисту наведена на рис. 4.1.1 Негативний полюс зовнішнього джерела струму 1 приєднаний до захищеної металевої конструкції 2, на поверхні якої діють локальні елементи, а позитивний полюс – до допоміжного електроду 3, що працює як анод. У процесі захисту анод активно руйнується і підлягає періодичному відновленню [4].
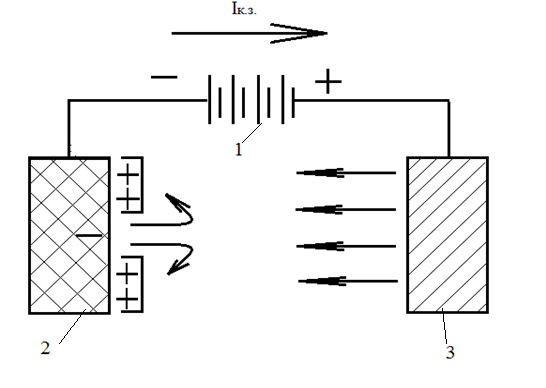
Рис. 4.1. Схема катодного захисту
Струм проходить у напрямку від допоміжного аноду до катодних і анодних ділянок корозійного елемента і повертається до джерела струму. Коли поляризація катодних ділянок зовнішнім струмом досягає потенціалу аноду, на всій поверхні металу встановлюється однаковий потенціал і локальний струм більше не проходить.
Джерела зовнішнього струму – станції катодного захисту, обов'язковими елементами яких є: перетворювач (випрямляч), що виробляє струм; струмопідвід до конструкції, яку захищають, електрод порівняння, анодні заземлювачі, анодний кабель [7].
Протекторний захист (рис 4.1.2) здійснюють під'єднанням до захищеної конструкції 1 електроду 2, що виготовлений з металу, який має значний електронегативний потенціал (Мg, Zn, Аl) [1].
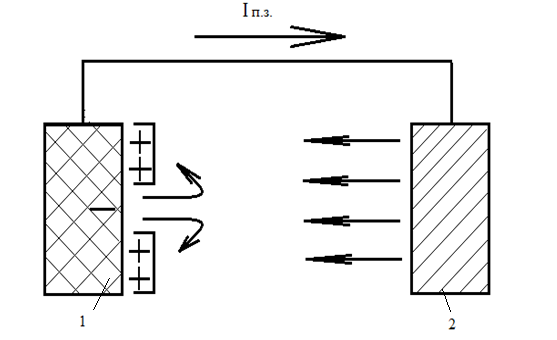
Рис. 4.1.2. Схема протекторного захисту
В утвореній контактній парі сталева конструкція є катодом, а приєднаний метал – анодом. В контурі виникає електричний струм, анод (протектор) поступово розчиняється, а потенціал конструкції знижується (внаслідок переходу електронів з протектора) до такої величини, що на ній можлива лише реакція відновлення (киснева або воднева деполяризація). Таким чином можна попередити корозію [9].
Принцип дії катодного захисту найкраще відображає корозійна діаграма (рис. 4.1.3). Без підведення зовнішнього струму між катодними та анодними ділянками встановлюється потенціал Екор.. Після накладання зовнішнього струму ізах. катод поляризується і його потенціал зрівнюється з потенціалом анода Еа0. Поверхня стає еквіпотенціальною і корозійний струм більше не проходить. Отже, за достатньо великої густини зовнішнього струму сумарний струм проходить по всій поверхні захищуваного об’єкту, включаючи анодні ділянки. Внаслідок цього відсутні умови переходу іонів металу в розчин [1].
Якщо поляризація металу дещо вища значення Еа0, то швидкість корозії дорівнюватиме нулю, а сумарний струм на анодних ділянках протікає з елементу в метал, тому іони цього металу не переходитимуть у розчин.
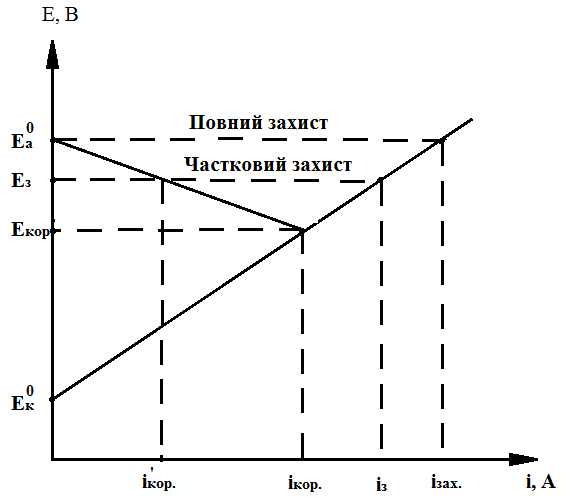
Рис. 4.1.3. Корозійна діаграма катодного захисту
Варто зазначити, що перезахист не дає позитивних результатів і може пошкодити амфотерні метали та покриття. На практиці застосовують струми, близькі до мінімальних [7].
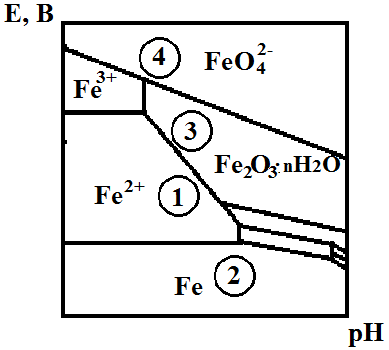
Рис. 4.1.4. Діаграма Пурбе для системи Fe-H2O за 25°С
Накладання зовнішнього струму зумовлює перехід кородуючого металу з області 1, де метал кородує з утворенням іонів Fe2+, в область стабільності Fe – 2 (рис. 4.1.4).
Анодний захист (рис. 4.1.5) здійснюють приєднанням захищеної металевої конструкції 2 до позитивного полюсу зовнішнього джерела постійного струму (регулятора потенціалу) 1 або до металу з більш позитивним потенціалом (катодний протектор). При цьому потенціал металу, який захищають, зміщується в позитивну сторону до досягнення стійкого пасивного стану. Необхідними елементами анодного захисту є катод-заземлювач 3, електрод порівняння 4, джерело струму та пристрій регулювання потенціалу 1.
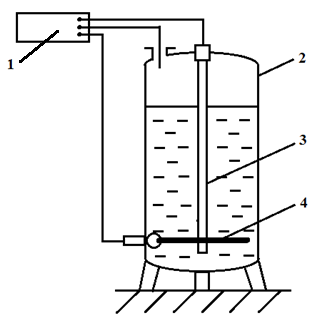
Рис. 4.1.5. Схема анодного захисту
Залежність швидкості розчинення (величини струму) металів, здатних до пасивації, від величини анодної поляризації має зображена на рис. 4.1.6 [1].
На початковій ділянці 1-2 при порівняно незначному збільшенні анодного потенціалу, різко зростає величина струму у колі. Це вказує на високу швидкість розчинення (корозії) матеріалу аноду. При значенні потенціалу в точці 2 швидкість електрохімічного руйнування металу максимальна. При подальшому зростанні значення потенціалу на ділянці 2-3 величина струму, а значить і швидкість розчинення металу, різко зменшується і залишається постійною (Іn) у досить широкому діапазоні зміни потенціалу (ділянка 3-4). При цьому поверхня металу пасивується. Для захисту хімічного обладнання інтервал області пасивного стану становить ~ 50 мВ. Збільшення потенціалу до значень, вищих Ет, призводить до зростання швидкості корозії (ділянка 4-5). Для забезпечення анодного захисту необхідне підтримування анодного потенціалу у межах Екр.<Е<Ет, яке забезпечує пасивний стан металу і гарантує гальмування корозійних процесів на поверхні металу. Густина струму при цьому є значно нижчою, ніж при катодному захисті [9].

Рис. 4.1.6. Поляризаційна анодна крива
Причиною зменшення швидкості корозії металу при збільшенні анодного потенціалу вище від Екр. є утворення на поверхні металу продуктів корозії. При цьому формується щільна захисна плівка, і метал переходить у стійкий пасивний стан [4].
Конструкцію чи виріб при анодному захисті підключають до джерела постійного струму лише на певний період – до утворення на поверхні металу оксидної плівки заданої товщини. Така плівка згодом захищає від корозії, як звичайне покриття.
На діаграмі Пурбе (рис. 4.1.4) анодний захист відбувається переміщенням системи з точки 1 (корозія) у точку 3 (пасивний стан). Під час перепасивації система переміщується у точку 4 [7].
 2017-10-31
2017-10-31 930
930








