1. Межмолекулярные окислительно-восстановительные реакции – реакции, в которых окислитель и восстановитель входят в состав разных веществ.
2. Внутримолекулярные окислительно-восстановительные реакции – реакции, в которых окислитель и восстановитель (атомы разных элементов) находятся в составе одного вещества.
3. Диспропорционирование (самоокисление – самовосстановление) – реакции, в которых окислителем восстановителем является один и тот же элемент, в одной той же степени окисления.
4. Конпропорционирование – реакции, в которых окислителем и восстановителем является один и тот же элемент в разных степенях окисления.
24) Электроды первого рода. Расчёт потенциала электрода. Уравнение Нернста. Электрохимический ряд напряжений металлов.
Электродный потенциал – скачок потенциала, возникающий под влиянием ряда факторов, на границе металл – раствор электролита. при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл – раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором.
Стандартный электродный потенциал металла – разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом
Ряд напряжений:Каждый левее стоящий металл вытесняет каждый правее стоящий металл из раствора его соли. Металл с меньшим потенциалом всегда будет окисляться (анодом), с большим – восстанавливаться (катодом).
Уравнение Нернста.
Зависимость электродного потенциала от концентрации одноименных ионов в растворе описывается уравнением НЕРНСТА:  ,где
,где  – стандартный (нормальный)
– стандартный (нормальный)
электродный потенциал металла, В;
 – универсальная газовая постоянная, 8,314 Дж/(моль×К);
– универсальная газовая постоянная, 8,314 Дж/(моль×К);
 – температура, К;
– температура, К;  – постоянная Фарадея, 96500Кл/моль;
– постоянная Фарадея, 96500Кл/моль;
 – активность ионов металла в растворе, моль/л;
– активность ионов металла в растворе, моль/л;
 – число электронов, принятых или отданных в ходе реакции.
– число электронов, принятых или отданных в ходе реакции.
25. Гальванические элементы. Это устройство, в котором химическая энергия превращается в электрическую. Элемент Якоба –Даниэля(русинок). Для нахождение ЭДС гальванического элементы из потенциала катода необходимо отнять потенциал анода. Е=(фи) катода- (фи)анода. при работе элементы концентрация ионов будет увеличиваться, а концентрация ионов меди уменьшаться. Поэтому при работе элемента его ЭДС со временем уменьшается.
26) Химические источники тока «Сухие» элементы, аккумуляторы, топливные элементы.
Химические источники тока, устройства, вырабатывающие электрическую энергию за счёт прямого преобразования химической энергии окислительно-восстановительных реакций. Первые Х. и. т. созданы в 19 в. (Вольтов столб, 1800; элемент Даниела — Якоби, 1836; Лекланше элемент, 1865, и др.). До 60-х гг. 19 в. Х. и. т. были единственными источниками электроэнергии для питания электрических приборов и для лабораторных исследований. Основу Х. и. т. составляют два электрода (один — содержащий окислитель, другой — восстановитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила (эдс), соответствующая свободной энергии окислительно-восстановительной реакции. Действие Х. и. т. основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на отрицательном электроде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи (создавая разрядный ток) к положительному электроду, где участвуют в реакции восстановления окислителя.
В зависимости от эксплуатационных особенностей и от электрохимической системы (совокупности реагентов и электролита) Х. и. т. делятся на гальванические элементы (обычно называются просто элементами), которые, как правило, после израсходования реагентов (после разрядки) становятся неработоспособными, и аккумуляторы, в которых реагенты регенерируются при зарядке — пропускании тока от внешнего источника (см. Зарядное устройство). Такое деление условно, т.к. некоторые элементы могут быть частично заряжены. К важным и перспективным Х. и. т. относятся топливные элементы (электрохимические генераторы), способные длительно непрерывно работать за счёт постоянного подвода к электродам новых порций реагентов и отвода продуктов реакции. Конструкция резервных химических источников тока позволяет сохранять их в неактивном состоянии 10—15 лет (см. также Источники тока).
27) Кинетика электродных процессов при электролизе. Явление поляризации, перенапряжение. Потенциал разложения. Электролиз – это окислительно-восстановительная реакция, протекающая на электродах под действием электрического тока.
Впервые предложен механизм электродных процессов электролиза расплава KF.
nHF, сопровождающийся одновременным про-
теканием на катоде нескольких реакций. Сначала идет разряд ионов H+
или ионов (HF)nH+
, а затем, после достижения соответ-
ствующего напряжения, в выделении водорода участвуют ионы K+
. Основной результат электролиза обеспечивается окислени-
ем на аноде ионов (HF)nF−
до молекулярного фтора, а на катоде − восстановление ионного комплекса K+
(HF)nF−
с выделением
молекулярного водорода. Механизм обоснован термодинамическим анализом возможных суммарных электрохимических ре-
акций, подтверждается теоретическими представлениями об электропроводности электролитов и объясняет аномальные явле-
ния электролиза расплава KF.
nHF. Расчетные значения равновесных напряжений наиболее вероятных суммарных электродных
реакций, обеспечивающих основной результат электролиза расплава KF.
nHF, равны 3,51 В для KF.
2HF при 363 К и 3,13 В для
KF.
HF при 523 К
28) Электролиз солей с растворимым и нерастворимым анодом.
При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен правее водорода, то выделяется металл.
При электролизе растворов солей, содержащих ионы, расположенные между Аl3+ и Н+ на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. При электролизе водного раствора соли активного металла кислородсодержащей кислоты (например, КNО3) ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород, а на аноде — кислород, и электролиз раствора нитрата калия сводится к электролитическому разложению воды.
Отметим, что электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты плавятся при очень высоких температурах.
29) Законы Фарадея. Выход по току.
Первый закон Фарадея: массы веществ, претерпевших изменения на электродах прямо пропорциональны электрохимическим эквивалентам веществ.
Электрохимическим эквивалентом называется масса вещества, изменяющаяся при прохождении 1 Кл электричества.
Второй закон Фарадея: масса вещества, претерпевшая изменения на электродах, прямо пропорциональна количеству прошедшего электричества Q.
Объединяя первый и второй законы Фарадея, получим, что 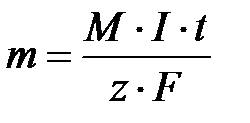 где М – молярная масса вещества, I – сила тока, t – время электролиза, z – число электронов, принимающих участие в полуреакции, F – постоянная Фарадея.
где М – молярная масса вещества, I – сила тока, t – время электролиза, z – число электронов, принимающих участие в полуреакции, F – постоянная Фарадея.
Для газообразных веществ можно записать аналогичное выражение 
30.Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2% железа — 4,1% кальция — 4,1% натрия — 2,3% магния — 2,3% калия - 2,1 % титана — 0,56% Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%. В природе металлы встречаются в различном виде: в самородном состоянии: серебро, золото, платина, медь, иногда ртуть в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др. в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др. различных солей: сульфидов: галенит PbS, киноварь НgS,.лоридов сульфатов карбонатов: мел, мрамор СаСО3, магнезит МgСО3.Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные. Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий. Извлечение металлов из руд: Концентрирование. Многие руды содержат нежелательные материалы, например глину или гранит. Восстановление вторая стадия извлечения металлов заключается в восстановлении их руд до металлического состояния. Рафинирование. Рафинирование (очистка) представляет собой последнюю стадию извлечения металлов. Для ее проведения используются различные методы, в том числе перегонка и электролиз.
31) Получение чистых и сверх чистых металлов. Электролитическое рафинирование. Зонная плавка. Другие методы очистки.
Руду цветного металла добывают из земли и очищают от большей части пустой породы. Но даже лучший, стопроцентный рудный концентрат - только сырьё. Его можно назвать сверхчистым концентратом, но металл в нем соседствует с большим количеством примесей. Чтобы получить чистый и сверхчистый металл, его нужно извлечь из искомого концентрата.
При обогащении руды разрушаются сравнительно слабые связи минералов в природе. Теперь же нужно вторгнуться внутрь минерала, внутрь соединения, порвать крепчайшие химические связи между элементами. Тут не обойдёшься действием центробежной силы или пузырьков пены, что применялось на обогатительных фабриках. Нужны более мощные средства. И, прежде всего,- высокие температуры. Та отрасль металлургии, которая их использует, носит имя пирометаллургии (от слова, означающего в переводе с греческого «огонь»).
В конечном счёте, перед металлургом опять окисел - только на этот раз не природный, а искусственный.
Наступает самый ответственный момент - «прощание» с кислородом. Принцип очень прост: кислороду «предлагают» какой-нибудь «лакомый» для него элемент - углерод, водород, кремний. А хром, титан, марганец, например, можно освободить от кислорода с помощью более дешёвого, чем они, алюминия.
Называется этот процесс восстановлением металлов из руд. Для того чтобы он мог идти, пускают в ход высокие температуры, расплавляя руду.
 2018-01-21
2018-01-21 620
620








